
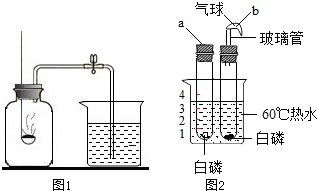
有这样一个改进实验,装置如图所示:
操作与现象如下:①取绿豆大小的白磷,用滤纸吸于后,放入大注射器中部,将活塞放到50mm处,拔掉针头,用胶皮管止水夹密封.②在铁架台上固定好装配的仪器,用酒精灯微热放有白磷的部位,当看到有大量白烟冒出时,说明反应发生.这时可观察到活塞向中心移动,待白烟消失,活塞随着仪器的冷却,慢慢移动到40mm刻度处.

问题:1.这个实验的目的是什么?2.实验的现象是什么?3.实验的结论是什么?4.实验的最大优点是什么?5.实验存在的问题是什么?
|
解答:(1)测定空气中氧气的含量. (2)冒出大量的白烟,放出热量. (3)空气中氧气约占1/5体积. (4)仪器易找,操作简单,准确度较高,且产生的热量推动活塞向右移动,增强了对化学反应放热的感性认识. (5)①注射器能否承受40℃以上的温度,如果炸裂有裂纹,则对实验的准确性会有影响.②为了测量准确,反应所用白磷要过量.白磷有剧毒,且易燃,因此必须注意剩余白磷的处理. 名师导引:同一个实验可以设计多种方法,但每一个实验都应规范操作.实验方法愈多,思路愈开阔.此实验利用白磷着火点(燃烧所需的最低温度)低(白磷的着火点为40℃))的特点,将白应放入大针管中,微热使其燃烧.白磷燃烧消耗氧气,大针管内空气中的氧气完全反应,针管内气压降低,活塞的位置会发生变化.由此,可以比较准确地测量空气中氧气的含量.但需注意的是针管器壁较厚,能否加热?白磷的用量应多一些,剩余的白磷应及时处理,因为白磷有剧毒. |


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| 1 |
| 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com