(1)写出下列反应的化学方程式
①用生石灰除去工厂排出的含有少量硫酸的废水______;
②硅酸的化学式为H2SiO3,氢氧化钾与硅酸反应的化学方程式为______.
(2)有两种外观类似黄金的(Ⅰ):Cu-Zn合金和(Ⅱ):Cu-Ag制品,若实验室只提供一瓶稀硫酸和必要仪器.
①你认为能测出合金______(填序号)中铜的质量分数;
②取上述(Ⅰ)中合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g.则可测出该合金中铜的质量分数是______.
解:(1)生石灰为CaO,和硫酸反应生成盐和水;硅酸是一种酸和氢氧化钾发生酸碱中和反应,生成盐和水,根据质量守恒定律配平即可.
故答案为:①CaO+H
2SO
4═CaSO
4+H
2O ②2KOH+H
2SiO
3═K
2SiO
3+2H
2O
(2)①由于Cu-Ag制品与稀硫酸不反应,Cu-Zn合金中的锌可以硫酸反应,所以可以根据生成氢气的质量来求出(Ⅰ)中铜的含量.
故答案为:(Ⅰ)
②设Cu-Zn合金中锌的质量为x
生成氢气的质量为:20g+50g-69.8g=0.2g
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
x 0.2g

解之得:x=6.5g
合金中铜的质量为:20g-6.5g=13.5g
合金中铜的质量分数=
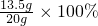
=67.5%
答:合金中铜的质量分数为67.5%
分析:(1)根据化学方程式的书写要求来完成,要注意反应原理、化学式的正确书写及方程式的配平.
(2)①Cu-Ag制品与稀硫酸不反应,Cu-Zn合金中的锌可以硫酸反应.
②反应前后烧杯中物质的质量差为生成氢气的质量,由氢气的质量,根据锌与硫酸反应的化学方程式可以求出锌的质量,进而求出铜的质量和质量分数.
点评:本题主要考查了学生对化学方程式的书写的掌握程度及根据化学方程式进行计算的能力.


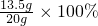 =67.5%
=67.5% 

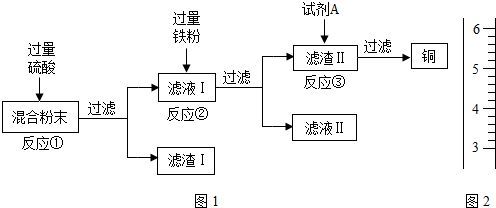

 已知A、B、C、D、E、F是初中化学中常见的六种物质,它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“
已知A、B、C、D、E、F是初中化学中常见的六种物质,它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“