
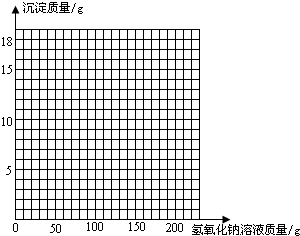
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
| 160 |
| x |
| 98 |
| 9.8g |
| 98 |
| 9.8g |
| 80 |
| y |
| 80 |
| z |
| 98 |
| 9.8g |
| 8g+8g |
| 10% |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验编号 | 温度 | 大理石 | 盐酸浓度 | 实验探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | ⅰ实验①和②探究浓度对反应快慢的影响. ⅱ实验②和 ⅲ实验①和③探究大理石粗细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | ||
| ③ | 细颗粒 | 5% | ||
| ④ | 40℃ | 10% |
| 方案 | 填是否合理 | 说明理由(写化学方程式) |
| 测溶液的pH是否小于7 | 合理 | 氯化钙是中性溶液,而盐酸呈酸性. |
| 滴加硝酸银溶液观察是否有白色沉淀生成 | ||
| 加铁粉观察是否有气泡 |
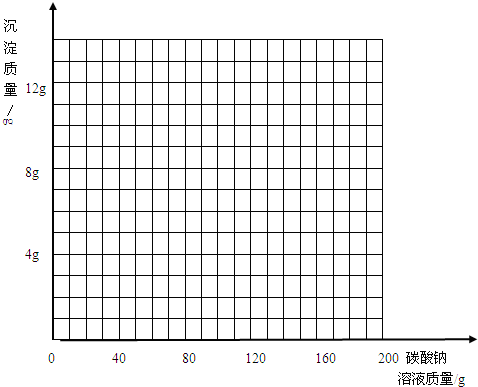
| 加入碳酸钠溶液的质量/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| 生成沉淀的质量/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 加入NaOH溶液的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 生成沉淀的质量/g | 0.0 | 0.00 | 2.45 | 4.90 | 4.90 |
查看答案和解析>>
科目:初中化学 来源:2012年湖北省鄂州市梁子湖区中考化学模拟试卷(解析版) 题型:填空题
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com