
某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
| A.Zn | B.Cu | C.Mg | D.Ag |
试题分析:铜、银不能和稀硫酸反应;解:设5.6g铁与足量的稀硫酸充分反应生成氢气的质量为X, Fe+H2SO4═FeSO4+H2↑56 25.6g X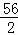 =
=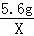 X=0.2g;解:设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y, Zn+H2SO4═ZnSO4+H2↑65 25.6g Y
X=0.2g;解:设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y, Zn+H2SO4═ZnSO4+H2↑65 25.6g Y 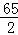 =
=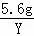 Y=0.17g,解:设5.6g镁与足量的稀硫酸充分反应生成氢气的质量为Z, Mg+H2SO4═MgSO4+H2↑24 25.6g Z
Y=0.17g,解:设5.6g镁与足量的稀硫酸充分反应生成氢气的质量为Z, Mg+H2SO4═MgSO4+H2↑24 25.6g Z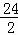 =
=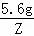 Z=0.47g,由以上计算可知,当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,当5.6g纯锌与足量稀硫酸反应时能够生成0.17g氢气,当5.6g纯镁与足量稀硫酸反应时能够生成0.47g氢气,由此可知,不纯的铁5.6g中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是镁.故选:C.
Z=0.47g,由以上计算可知,当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,当5.6g纯锌与足量稀硫酸反应时能够生成0.17g氢气,当5.6g纯镁与足量稀硫酸反应时能够生成0.47g氢气,由此可知,不纯的铁5.6g中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是镁.故选:C.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:2013年初中毕业升学考试(四川达州卷)化学(解析版) 题型:选择题
某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A.Zn B.Cu C.Mg D.Ag
查看答案和解析>>
科目:初中化学 来源:2013年四川省达州市中考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com