
【题目】下面是对“2”的含义的解释,其中错误的是( )
A.Fe2+:每个亚铁离子带2个单位正电荷
B.Ba(OH)2:氢氧化钡的化学式中钡离子和氢氧根离子的个数比是1:2
C.![]() :带2个单位正电荷的镁离子
:带2个单位正电荷的镁离子
D.2SO42-:2个硫酸根离子,每个硫酸根离子带2个单位负电荷
【答案】C
【解析】
A、根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,Fe2+表示每个亚铁离子带2个单位正电荷,故A正确;
B、根据右下角的数字表示每个分子中含有该原子或原子团的个数,Ba(OH)2表示氢氧化钡的化学式中钡离子和氢氧根离子的个数比是1:2,故B正确;
C、根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,![]() 表示镁的化合价为+2,故C错误;
表示镁的化合价为+2,故C错误;
D、根据离子的表示方法可知:2SO42-表示2个硫酸根离子,每个硫酸根离子带2个单位负电荷,故D正确。故选C。


科目:初中化学 来源: 题型:
【题目】A、B、C、D 四个烧杯中分别盛有相等质量的水,在温度相同的条件下,向四个烧杯中分别加入 20 g、15 g、10 g、5 g 某物质,充分溶解后观察到如图所示的现象.请完成下列问题:
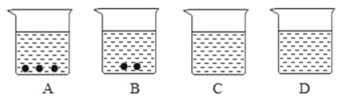
(1)在 A、B、C、D 四个烧杯中,_______ 中盛的一定是饱和溶液;_______ 中盛的一定不是饱和溶液;__________中盛的可能是饱和溶液.
(2)若固体是 KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是_____.
(3)在一定温度下,往 A、B 中加入相同质量的水,B 中固体刚好溶解,A 中固体能否全部溶解?_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
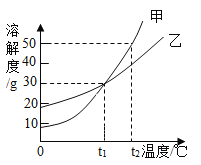
A. t1℃时,甲和乙的溶解度相等,都是30
B. t1℃时,将甲、乙两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C. 温度从t2℃降至t1℃时,甲和乙的饱和溶液中析出晶体的质量甲大于乙
D. t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我市某超市的某种加钙食盐包装标签上的部分文字如下,请仔细阅读后回答以下问题:

(1)包装标签上钙含量是指什么(填单质钙、碳酸钙、钙元素中的一种)。
(2)为了测定此盐中的钙含量是否属实,取20g这种加钙食盐,加入足量稀盐酸,经测得生成0.264g二氧化碳。请计算20g此加钙食盐中碳酸钙的质量分数。(要求写出计算过程)。
(3)通过计算判断,此盐中的钙含量是否属实?(填“是”或“否”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A是地壳中含量最丰富的元素;由B组成的物质在A元素组成的物质中剧烈燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体E;C的原子核内有9个质子;D原子的核外有11个电子。根据以上条件回答:
(1)写出A、B的元素名称:A______;B______。
(2)写出C、D的元素符号:C______;D______。
(3)写出气体E的化学式_____。
(4)画出D+结构示意图_______,它是______结构。
(5)写出A和B反应生成E的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】I、现有氢气、氯酸钾、锌、稀硫酸、二氧化锰、氧化铜、红磷、氧气八种物质,从中选择适当的物质,按下列要求进行反应,写出反应的化学方程式。
(1)置换反应,有气体生成:______;
(2)分解反应:_______;
(3)化合反应,产生大量白烟:_______;
(4)置换反应,有金属单质生成:______。
II、写出:(1)有黑色固体生成的化合反应的化学方程式_____;
(2)实验室用一种纯净物制取氧气的化学方程式_____;
(3)市售打火机里装的不是汽油,而是液体丁烷(C4H10),丁烷在空气中燃烧后生成二氧化碳和水蒸气,写出丁烷完全燃烧的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于碳和碳的氧化物知识网络图(图中“→” 表示转化关系,“……”表示相互能反应)说法正确的是
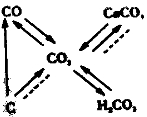
A.“C……CO2”的反应是放热反应
B.“CO→CO2”的反应类型为置换反应
C.“CO2→CaCO3”的反应可用于检验二氧化碳
D.“CO2![]() H2CO3”的反应可用酚酞试剂验证
H2CO3”的反应可用酚酞试剂验证
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数.
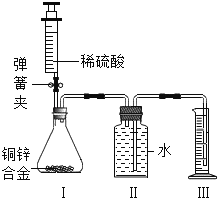
探究过程如下:
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应)
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为 ,实验过程中须加入稀硫酸至不再产生气体,目的是 .
(2)步骤③中称量剩余固体之前的正确操作是 、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中 (填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有 (填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:
步骤1:利用右图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
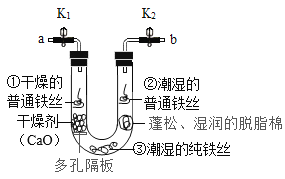
(1)步骤1中,检验U形管内已充满O2的方法是________。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有_______(填化学式),②处可能观察到的现象是_______,③处没有明显变化,说明纯铁的抗腐蚀能力较____(填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到_____现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁):__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com