B
分析:A、依据部分变质的氢氧化钠中含有碳酸钠以及放入盐酸后的反应顺序分析解答;
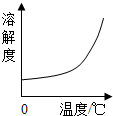
B、依据气体的溶解度随温度的升高而降低的原理分析解答;
C、依据两者的金属活动性顺序的应用分析解答;
D、依据硫酸稀释后的酸性变化情况分析解答;
解答:A、由于部分变质的氢氧化钠中含有碳酸钠,而放入盐酸后先要与氢氧化钠反应生成氯化钠和水,故开始后该反应的过程中无气体产生,氢氧化钠反应完全后盐酸会与碳酸钠反应生成二氧化碳直至反应结束气体质量不会变化;
B、由于气体的溶解度随温度的升高而降低,所以该图象应该是一条下降的曲线;
C、镁的金属活动性比铁强,故与稀盐酸反应时镁的反应速度要快一些(图象更陡一些),由于金属与酸反应生成氢气的质量=金属的质量×

,所以同质量的镁要比铁生成的氢气要多,故最终镁的曲线应该在铁的上面;
D、由于硫酸稀释时酸性会不断减弱,故其pH会不断增大,但不管怎样稀释溶液也不会呈中性,即溶液的pH只能永远的接近7但不会达到7;
故选B
点评:根据曲线的纵横坐标轴的说明,判断曲线所表示的变化关系,此是正确答题的根本.




 ,所以同质量的镁要比铁生成的氢气要多,故最终镁的曲线应该在铁的上面;
,所以同质量的镁要比铁生成的氢气要多,故最终镁的曲线应该在铁的上面;




