
分析 根据图示测得的相关数据及相关的过氧化氢分解的化学方程式,依据质量守恒定律计算生成氧气的质量,再根据已知的氧气质量代入化学方程式求得参加反应的过氧化氢的质量即可.
解答 解:
(1)根据质量守恒定律,反应生成氧气的质量为68g+1.2g-67.6g=1.6g;故填:1.6g;
(2)设69 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 1.6g
$\frac{68}{x}=\frac{32}{1.6g}$
x=3.4g
答案:(1)1.6g;(2)溶液中含有过氧化氢的质量为3.4g.
点评 解此题的关键是根据图示测得的相关数据及质量守恒定律计算出隐藏的已知量---生成的氧气质量;进而按化学方程式的解题格式解答即可.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 测定空气中氧气含量的实验中,可以将铜丝换成木炭 | |
| B. | 氧气的化学性质比较活泼,是可燃物 | |
| C. | 铁丝在氧气中剧烈燃烧,发出耀眼的白光,生成黑色固体 | |
| D. | 从空气中分离出的氮气可用于食品防腐 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体,某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示,同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体,某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示,同学们对这包久置的“504双吸剂”的固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ、取少量固体加入足量蒸馏水,搅拌溶解 | 固体部分溶解,并放出大量热 | 固体中一定含有CaO |
| Ⅱ、取滤渣加入足量稀盐酸 | 固体逐渐消失,产生大量无色气体,得到浅绿色溶液 | 固体中一定含有Fe,一定不含有Fe2O3 |
| Ⅲ、将操作Ⅱ中产生的气体通入到澄清石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有CaCO3 |
| 实验操作 | 实验现象 | 实验结论 |
| 取少量待测样品,用磁铁分离出铁粉,然后向取残留固体中加入适量稀盐酸 | 溶液变为棕黄色 | 固体中有Fe2O3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市区九年级一模调研测试化学试卷(解析版) 题型:信息分析题
黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ. 称取2.40 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
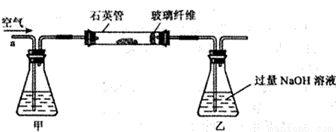
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:

【问题讨论】
(1)Ⅰ装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是______________。
(2)Ⅰ装置中乙瓶内发生反应的化学反应方程式是____________________。
【含量测定】
(3)计算该黄铁矿中FeS2的质量分数__________________。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会________________(填“偏大”“偏小”或“不变”)。
(5)Ⅱ中检验滤渣是否洗涤干净的方法是,取最后一次洗涤液,加入_____________,说明已洗涤干净。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:

(6)接触室中发生反应的化学方程式为________________________。化学实验室常需要用到较稀的硫酸,把浓硫酸稀释的操作是_______________________________________,硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途______________________。
(7)依据生产硫酸的工艺流程图,下列说法正确的是_______________(填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.沸腾炉排出的矿渣可供炼铁 D.吸收塔中为了提高吸收效率,采用喷淋的方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com