
【题目】某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计如图所示实验。依据实验流程回答相关问题。
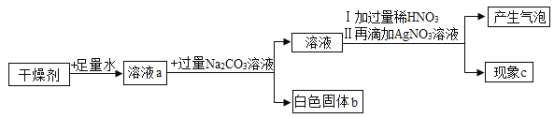
(1)向溶液a中加入紫色石蕊试液,现象是__________________。
(2)白色固体b一定是_______________(填化学式)。
(3)加入过量稀HNO3的目的是_______________。
(4)现象c:①若无白色沉淀,干燥剂成分为_______________。
②若有白色沉淀,写出产生此现象的化学方程式_______________。
【答案】溶液变蓝 CaCO3 完全除去NaOH、Na2CO3,以免干扰检验CaCl2 CaO和NaOH ![]()
【解析】
(1)某干燥剂含有CaO 、NaOH和CaCl2中的两种物质,氧化钙遇水会反应生成氢氧化钙,加水后形成的溶液a(至少含有氢氧化钙或氢氧化钠中的一种)一定呈碱性,所以溶液a中加入紫色石蕊试液,溶液一定会是蓝色。故填:溶液变蓝。
(2)溶液a中加入过量碳酸钠后形成白色固体b,而干燥剂中含有CaO 、NaOH和CaCl2中的两种物质,氧化钙遇水反应生成氢氧化钙,所以白色固体b一定是碳酸钠与氢氧化钙或氯化钙反应生成的碳酸钙沉淀。故填:CaCO3。
(3)溶液a中加入过量碳酸钠后,碳酸钠与氢氧化钙反应生成碳酸钙沉淀与氢氧化钠,或是碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠溶液,溶液中一定会有碳酸钠,可能含有氢氧化钠或氯化钠,向溶液中加入过量稀HNO3,再滴加硝酸银,硝酸银与氯化钠反应会生成氯化银白色沉淀,目的是想检验溶液中是否含有氯化钠,从而确定干燥剂中是否含有氯化钙,但是氢氧化钠和碳酸钠会对氯化钠的检验造成干扰,它们遇到硝酸银也会产生白色沉淀,为排除他们的干扰,所以加入过量稀硝酸,将氢氧化钠和碳酸钠都转化为硝酸钠和水及二氧化碳(逸散到空气中),所以加入过量稀HNO3的目的是完全除去NaOH、Na2CO3,以免干扰检验CaCl2。故填:完全除去NaOH、Na2CO3,以免干扰检验CaCl2。
(4)根据以上分析,加入过量稀硝酸,稀硝酸与氢氧化钠和碳酸钠分别反应后会生成硝酸钠、水和二氧化碳(跑走),若溶液中有氯化钠,硝酸银与氯化钠反应会生成氯化银白色沉淀,现象c:①若无白色沉淀,干燥剂中不含氯化钙,所以干燥剂的成分为CaO和NaOH。故填:CaO和NaOH。
②若有白色沉淀,硝酸银与氯化钠反应生成氯化银沉淀和硝酸钠,产生此现象的化学方程式![]() 。
。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:初中化学 来源: 题型:
【题目】探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图像分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是()
A.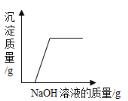 在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
B.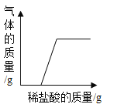 在NaOH溶液中加入CaCO3,然后向其中逐滴加入稀盐酸
在NaOH溶液中加入CaCO3,然后向其中逐滴加入稀盐酸
C.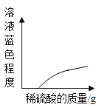 在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D. 在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
在NaOH溶液中加入Ba(NO3)2,然后向其中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.非金属元素原子的最外层电子数都多于 4 个
B.参加反应的各物质质量总和等于反应后的各物质的质量总和
C.若等质量的铁、镁和铝三种金属,分别与足量的等溶质质量分数的稀盐酸充分反应后,生成氢气质量的大小依次为 x、y 和 z,则 z>y>x
D.从粒子角度看,稀硫酸和浓硫酸的共同点是它们都含有氢离子和硫酸根离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列实验装置图,回答有关问题:
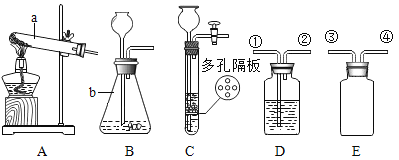
(1)仪器b的名称为_______。
(2)实验室用高锰酸钾制取氧气应选择的发生装置是_______(填字母),该反应的化学方程式为______。
(3)对于实验室制取气体,小虹总结了如下规律,你认为正确的是________。
a反应必须加热.
b反应物必须是纯净物
c生成物中只有一种气体
(4)实验室常用装置C代替B制取气体,装置C的优点是________。
(5)实验室用B制取气体,欲验证制得的气体为二氧化碳,应在装置D中盛放_______试剂(填试剂名称),并把气体从________端通人,该装置中发生的化学反应的方程式为_________。
(6)用E收集二氧化碳,从③端通人,请把装置图补画齐全。(请将补充完整的E装置图画在答题卡.上相应的位置)________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知甲、乙、丙、丁四种物质,它们在化学反应中的关系是:![]() 。对于此反应,下列说法正确的是
。对于此反应,下列说法正确的是
A.若甲与丙是单质、乙与丁是化合物,则该反应一定是置换反应
B.若丙、丁为盐和水,则甲和乙一定是酸和碱
C.若甲为10 g、乙为20 g,反应后生成的丙和丁的质量总和一定为30g
D.若该反应为复分解反应,则生成物中一定有水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量变化趋势如图所示,下列说法正确的是
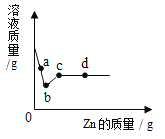
A.c点溶液中溶质为Zn(NO3)2
B.a点溶液中溶质只有2种
C.若取b~c 段之间的溶液,滴加稀盐酸,无白色沉淀产生
D.取d点的固体,加入稀盐酸,无气泡产生
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初中化学常见物质的转化关系如下图,部分反应物、生成物和反应条件未标出。其中AC 常温下是液态,D与E的组成元素相同,B、D、E在通常状况下是气体,F可用来 改良酸性土壤,G是石灰石的主要成分,M是一种黑色固体粉末。
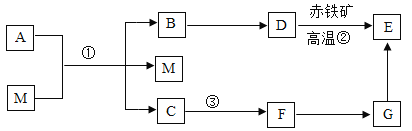
请完成下列问题:
(1)写出物质 A 的化学式_______;
(2)物质 M 在反应①中所起的作用是_________;
(3)反应③中伴随着_____(填"放热"或 “吸热”)现象;
(4)写出反应②的化学方程式________;
(5)写出实验室检验气体 E 的化学方程式_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有盐酸和铁锈反应后的溶液,为测定溶液中氯化铁的含量,某化学活动小组称取样品溶液50g放入锥形瓶中,再向锥形瓶中滴加氢氧化钠溶液,反应过程中产生沉淀质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
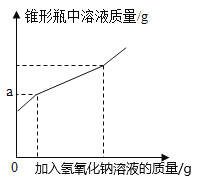
加入氢氧化钠溶液的质量/g | 70 | 90 | 120 | 140 |
产生沉淀的质量/g | 2.14 | 3.21 | 4.28 | m |
(1)表中m的值是 ;
(2)50克样品中氯化铁的质量分数是 ;
(3)求该实验中所用氢氧化钠溶液的溶质质量分数。(写出计算过程)
(4)如图图象中a的数值是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习金属活动性顺序时,老师说:“排在前面的金属能将后面的金属从他们的盐溶液中置换出来,但是K、Ca、Na除外,因为K、Ca、Na能与溶液中的水发生反应”。对这个问题,课外小组的同学很感兴趣,展开了金属与水反应的探究。
探究I: 探究钠、镁能否与水反应
分别将等质量的镁条打磨干净投入25oC和100oC的沸水中,观察记录实验现象:
实验序号 | ① | ② | ③ |
实验装置 |
|
|
|
实验 现象 | 钠浮在水面上,不断跳动,很快收集到一试管气体,金属钠最后消失 | 有细小气泡,镁条逐渐变灰黑色,10分钟后无明显变化 | 有较大气泡冒出,镁条逐渐变灰黑。约5分钟后,无明显现象 |
向烧杯中滴加酚酞,变红 | 收集约5mL气体,取出试管,将燃着的木条伸入试管中,有尖锐的爆鸣声 |
发现问题:镁条为什么不能持续冒出气泡。
查阅资料: Mg(OH)2难溶于水;NH4+和HCO3-可以加快Mg与水反应。
探究II:探究NH4+和HCO3-对Mg与水反应是否有促进作用
用探究I与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。
实验序号 | a | b | c | d |
盐溶液(浓度相同) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
5.1 | 8.3 | 7 | 7.8 | |
30min时产生气体体积(mL) | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | H2 | |||
30min时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
根据以上探究回答下列问题:
(1)钠与水反应后的液体显__________(填“酸性”、“碱性”、“中性”)。
(2)由探究I推出钠具有的一条物理性质是__________。
(3)证明镁条能与水发生反应的证据是__________。
(4)通过以上探究得出Mg与水反应的化学方程式为__________。
(5探究II中能够说明HCO3-对Mg与水反应起促进作用的证据是_________。
(6)分析探究全过程,得出影响金属与水反应速率的因素有__________(至少答两点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com