
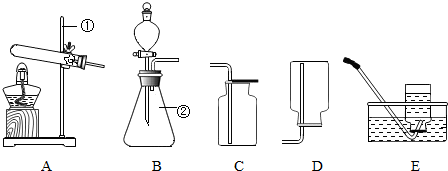
| ±ąŗÅ | ŹµŃéÄŚČŻ | ŹµŃéĻÖĻó | ŹµŃé½įĀŪ |
| 1 | Č”·“Ó¦ŗó¹ĢĢåŹ£ÓąĪļ0.2g ¼ÓČė5mL6%µÄH2O2ČÜŅŗ | ¾ēĮŅ·“Ó¦£¬·ÅČČ ²śÉś“óĮæĘųÅŻ | Éś³ÉĪļÖŠµÄMnO2 “߻ƷֽāH2O2 |
| 2 | Č”0.2g MnO2 ¼ÓČė5mL6% £ØH2O2ÖŹĮæ·ÖŹż£©µÄH2O2ČÜŅŗ | Ę½ĪČ·“Ó¦£¬·ÅČČ£¬³ÖŠų²śÉśĘųÅŻ | MnO2 “ᯒ ·Ö½āH2O2 |
| 3 | Č”·“Ó¦ŗó¹ĢĢåŹ£ÓąĪļ1.0g£¬¼ÓČė×ćĮæĖ®£¬³ä·ÖČܽā£¬¹żĀĖ | ¹ĢĢåĶźČ«Čܽā£¬ĀĖÖ½ ÉĻĪŽŗŚÉ«¹ĢĢå²ŠÓąĪļ | ¹ĢĢåŹ£ÓąĪļÖŠĪŽ MnO2 |
·ÖĪö £Ø1£©øł¾ŻŹµŃéŹŅ³£ÓĆŅĒĘ÷½ā“š£»
£Ø2£©øł¾ŻÓĆĖ«ŃõĖ®ŗĶ¶žŃõ»ÆĆĢÖĘŃõĘų¾Ķ²»ŠčŅŖ¼ÓČČ£¬ŹōÓŚ¹ĢŅŗ³£ĪĀŠĶ½ā“š£»
£Ø3£©øł¾ŻŹµŃéÄŚČŻæÉÖŖ£¬ŹĒŅŖ¼ģŃéøßĆĢĖį¼Ų·Ö½āµÄ²śĪļÖŠŹĒ·ńÓŠMnO2”¢ŹĒ·ń“߻ƷֽāH2O2£¬ŹµŃé2ŹĒÓėŹµŃé1¶Ō±Č£¬Č·¶ØMnO2ŹĒ·ńĘš“ß»Æ×÷ÓĆ£¬ŹµŃé3ŹĒ·ÖĪö·“Ó¦²śĪļÖŠŹĒ·ńÓŠMnO2£¬“Ó¶ų·“Ó³³öŹµŃé1²»ŃĻĆÜ£¬Ņ²æÉÄÜŹĒ·Ö½āŗóµÄĘäĖūĪļÖŹĘš“ß»Æ×÷ÓĆ£»
¢ņ”¢¾ŻĖłøųŠÅĻ¢£ŗKMnO4ŹÜČČ·Ö½āŹ±£¬»į·¢ÉśŅŌĻĀĮ½øö·“Ó¦£¬æɾŻ·½³ĢŹ½·Ö±š¼ĘĖć³öČō·¢Éśµ„Ņ»·“Ӧɜ³ÉŃõĘųµÄÖŹĮ棬ŅņĪŖĮ½øö·“Ó¦Ķ¬Ź±·¢Éś£¬ĖłŅŌÉś³ÉŃõĘųµÄÖŹĮæÓ¦ŌŚ¶žÕßÖ®¼ä£»
¾ŻKMnO4ŌŚ43.9”ꔫ377.9”ę·¶Ī§ÖŠµÄŹ§ÖŲĀŹ£ØO2ÓėKMnO4ÖŹĮæ±Č£©ĪŖ18.0%£¬½įŗĻŅŌÉĻ·½³ĢŹ½¼ĘĖ揧ÖŲĀŹ£¬ĶĘ²ā·¢ÉśµÄÖ÷ŅŖ»Æѧ·“Ó¦£®
½ā“š ½ā£ŗ
£Ø1£©øł¾ŻŹµŃéŹŅ³£ÓĆŅĒĘ÷æÉÖŖ£ŗ¢ŁĢś¼ÜĢØ£»¢Ś×¶ŠĪĘ棻
£Ø2£©Čē¹ūÓĆĖ«ŃõĖ®ŗĶ¶žŃõ»ÆĆĢÖĘŃõĘų¾Ķ²»ŠčŅŖ¼ÓČČ£¬ŹōÓŚ¹ĢŅŗ³£ĪĀŠĶ£»¹żŃõ»ÆĒāŌŚ¶žŃõ»ÆĆĢ×ö“߻ƼĮµÄĢõ¼žĻĀÉś³ÉĖ®ŗĶŃõĘų£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2”ü£»Čō·“Ó¦¹żÓŚ¾ēĮŅ£¬“ÓŹµŃé°²Č«½Ē¶Čæ¼ĀĒ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ¼õ»ŗŅŗĢåµĪ¼ÓĖŁĀŹ»ņ¼õµĶ·“Ó¦ĪļµÄÅØ¶Č»ņ“ņæŖĻšĘ¤Čū£»
£Ø3£©¢ŁŹµŃé2ŹĒÓėŹµŃé1¶Ō±Č£¬Č·¶ØMnO2ŹĒ·ńĘš“ß»Æ×÷ÓĆ£¬ŌņĖłČ”H2O2ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżÓ¦ĻąĶ¬£¬ŹµŃé3Č”·“Ó¦ŗó¹ĢĢåŹ£ÓąĪļ1.0g¼ÓČė×ćĮæĖ®ÖŠ£¬³ä·ÖČܽā£¬¹żĀĖŗó¹ĢĢåĶźČ«Čܽā£¬ĖµĆ÷²»ŗ¬MnO2£¬ŅņĪŖMnO2²»ČÜÓŚĖ®£»
¢ŚŹµŃé2ŹĒÓėŹµŃé1×÷¶Ō±Č£¬Č·¶ØMnO2ŹĒ·ńĘš“ß»Æ×÷ÓĆ£»
¢ŪÓÉŹµŃé3æÉÖŖ·“Ó¦²śĪļÖŠŹĒ·ńÓŠMnO2£¬“Ó¶ų·“Ó³³öŹµŃé1²»ŃĻĆÜ£¬Ņ²æÉÄÜŹĒ·Ö½āŗóµÄĘäĖūĪļÖŹĘš“ß»Æ×÷ÓĆ£»
¢ÜČō·¢ÉśµÄŹĒa·“Ó¦£¬Éč8.0gKMnO4£¬¼ÓČČŹ¹Ö®ĶźČ«·Ö½ā£¬Éś³ÉO2µÄÖŹĮæĪŖx
6KMnO4$\frac{\underline{\;\;”÷\;\;}}{\;}$2K2MnO4+K2Mn4O8+4O2”ü
6”Į158 4”Į32
8.0g x
$\frac{6”Į158}{8.0g}=\frac{4”Į32}{x}$
x=1.08g
Čō·¢ÉśµÄŹĒb·“Ó¦£¬Éč8.0gKMnO4£¬¼ÓČČŹ¹Ö®ĶźČ«·Ö½ā£¬Éś³ÉO2µÄÖŹĮæĪŖy
KMnO4$\frac{\underline{\;\;”÷\;\;}}{\;}$KMnO2+O2”ü
158 32
8.0g y
$\frac{158}{8.0g}=\frac{32}{y}$
y=1.62g
ŅņĪŖKMnO4ŹÜČČ·Ö½ā£¬»į·¢ÉśŅŌÉĻĮ½øö·“Ó¦£¬ĖłŅŌÉś³ÉŃõĘųµÄÖŹĮæ½éÓŚ1.08gŗĶ1.62gÖ®¼ä£¬¹ŹCŃ”ĻīÕżČ·£»
¢ŻÓÉĢāŅāæÉÖŖ£ŗKMnO4ŌŚ43.9”ꔫ377.9”ę·¶Ī§ÖŠµÄŹ§ÖŲĀŹ£ØO2ÓėKMnO4ÖŹĮæ±Č£©ĪŖ18.0%£¬¾Ż·½³ĢŹ½æÉÖŖ£ŗŌŚa·“Ó¦ÖŠŹ§ÖŲĀŹĪŖ£ŗ$\frac{4”Į32}{6”Į158}$”Ö0.135£¬b·“Ó¦ÖŠŹ§ÖŲĀŹĪŖ£ŗ$\frac{32}{158}$”Ö0.201£¬æÉŅŌ·¢ĻÖ£¬“ĖŹ±µÄŹ§ÖŲĀŹĪŖ18.0%£¬ÓėbµÄŹ§ÖŲĀŹ½ĻĪŖ½Ó½ü£¬¹ŹŌŚ43.9”ꔫ377.9”ę·¶Ī§ÖŠ£¬KMnO4·Ö½ā·“Ó¦Ö÷ŅŖŅŌbĪŖÖ÷£»
¹Ź“š°øĪŖ£ŗ
£Ø1£©Ģś¼ÜĢØ£» ׶ŠĪĘ棻
£Ø2£©2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2”ü£» B£» ¼õ»ŗŅŗĢåµĪ¼ÓĖŁĀŹ»ņ¼õµĶ·“Ó¦ĪļµÄÅØ¶Č»ņ“ņæŖĻšĘ¤Čū£»
£Ø3£©
¢Ła£ŗ6%£»b£ŗ
¢ŚŗĶŹµŃé1½ųŠŠ¶Ō±Č£¬Č·¶ØMnO2ŹĒ·ńĪŖĘš“ß»Æ×÷ÓĆ£»
¢ŪæÉÄÜŹĒ·Ö½āŗó²śĪļÖŠĘäĖūĪļÖŹĘš“ß»Æ×÷ÓĆ£»
¢ÜC£»
¢Żb£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éѧɜŅĄ¾ŻĢāŅā·ÖĪö½ā¾öĪŹĢāµÄÄÜĮ¦£¬Ė¼Ī¬ŗ¬Įæ½Ļ“ó£¬ÕĘĪÕĻą¹ŲÖŖŹ¶²¢ÄÜŅĄ¾ŻĢāÄæŠÅĻ¢Įé»ī·ÖĪö½ā“šĪŹĢā£¬²ÅÄÜµĆ³öÕżČ·“š°ø£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×ÓµÄÖŹĮæÖ÷ŅŖ¼ÆÖŠŌŚŌ×ÓŗĖÉĻ | |
| B£® | ·Ö×ÓŌŚ»Æѧ±ä»ÆÖŠ²»»įĘĘĮŃ | |
| C£® | »Æѧ±ä»ÆÖŠŌŖĖŲµÄÖÖĄą²»»į±ä»Æ | |
| D£® | »Æѧ±ä»Æ·Ö×Ó·ÖĮŃ³ÉŌ×Ó”¢Ō×ÓÖŲŠĀ×éŗĻ³ÉŠĀ·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŃĒĢśĄė×Ó£ŗFe2+ | B£® | ŃõŌ×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ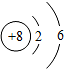 | ||
| C£® | “æ¼ī£ŗNa2CO3 | D£® | Į½øöµŖ·Ö×Ó£ŗ2N |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NO2”¢N2ŗĶæÉĪüČėæÅĮ£Īļ | B£® | CO2”¢N2”¢O2 | ||
| C£® | CO2”¢O2 ŗĶSO2 | D£® | SO2”¢NO2ŗĶæÉĪüČėæÅĮ£Īļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ĻĀĮŠŃ”Ļī·ūŗĻĶ¼Ź¾“ÓŹō¹ŲĻµµÄŹĒ£Ø””””£©
ĻĀĮŠŃ”Ļī·ūŗĻĶ¼Ź¾“ÓŹō¹ŲĻµµÄŹĒ£Ø””””£©| A | B | C | D | |
| X | Ńõ»Æ·“Ó¦ | “æ¼ī | “æ¾»Īļ | ½šŹō |
| Y | »ÆŗĻ·“Ó¦ | ¼ī | »ÆŗĻĪļ | µ„ÖŹ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
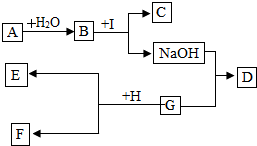 ČēĶ¼ŹĒ³õÖŠ»Æѧ֊³£¼ūµÄĪļÖŹÖ®¼äµÄ×Ŗ»» ¹ŲĻµ£¬ĘäÖŠAĪŖ³£ÓƵď³Ę·øÉŌļ¼Į£¬CĪŖ°×É«³Įµķ£¬D ĪŖĄ¶É«³Įµķ£¬EĪŖŗģÉ«µÄ¹ĢĢåµ„ÖŹ£®ĒėÄć»Ų“šĪŹĢā£ŗ
ČēĶ¼ŹĒ³õÖŠ»Æѧ֊³£¼ūµÄĪļÖŹÖ®¼äµÄ×Ŗ»» ¹ŲĻµ£¬ĘäÖŠAĪŖ³£ÓƵď³Ę·øÉŌļ¼Į£¬CĪŖ°×É«³Įµķ£¬D ĪŖĄ¶É«³Įµķ£¬EĪŖŗģÉ«µÄ¹ĢĢåµ„ÖŹ£®ĒėÄć»Ų“šĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com