
分析 (1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
(2)根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,根据质量分数公式计算即可.
解答 解:(1)根据质量守恒定律,反应生成氧气的质量=68g+1.0g-67.4g=1.6g;故答案为:1.6
(2)设68.0 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 1.6g
$\frac{68}{x}$=$\frac{32}{1.6g}$
x=3.4g
即:过氧化氢溶液中溶质的质量为3.4g
过氧化氢溶液的溶质的质量分数=$\frac{3.4g}{68g}$×100%=5.0%
答:过氧化氢溶液中纯H2O2的质量分数为5.0%
点评 本题主要考查学生根据质量守恒定律;运用化学方程式和质量分数公式进行计算的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③④ | D. | ① |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
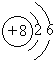 是氧原子的结构示意图,那么,1mol 氧气分子中含有9.632×1024个电子.
是氧原子的结构示意图,那么,1mol 氧气分子中含有9.632×1024个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com