
某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2。得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2;
猜想二:CaCl2和CaCO3;
猜想三:CaCl2和HCl。
| | 操作 | 现象 | 结论 |
| 步骤一 |  | | 猜想二成立 |
| 步骤二 |  | |
探究对象是固体,而猜想三中的HCl是气体;固体部分溶解;固体溶解,产生气泡;
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)①Mg(OH)2 ②酸 (3)②③
解析试题分析:复分解反应发生的条件是:有水生成,有沉淀生成,有气体生成,只要具备其中的一个条件反应即可发生。
“猜想三”不成立的理由是探究对象是固体,而猜想三中的HCl是气体,故填:探究对象是固体,而猜想三中的HCl是气体。
结论是猜想二成立,那么固体是氯化钙和碳酸钙的混合物,加入水时,氯化钙能够溶解,碳酸钙不能溶解;碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳,故填:固体部分溶解;固体溶解,产生气泡。
(1)碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)①由Ca(OH)2+YCla=CaCl2+Z↓可知,Z应该是一种碱,不溶于水的碱有氢氧化镁、氢氧化锌、氢氧化铜等,那么Z可能是氢氧化镁,故填:Mg(OH)2。
②中的生成物是盐和水,结合CaXm+2YClb=CaCl2+H2O可知,反应物应该是金属氧化物和酸,那么“YClb”属于酸,故填:酸。
(3)氯化钙能和硝酸银反应生成氯化银沉淀硝酸钙,能和碳酸钠反应生成碳酸钙沉淀和氯化钠,不能和硝酸、氢氧化铁、碳酸钡反应,故填:②③。
考点:考查实验探究物质的组成成分以及含量


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:探究题
为探究二氧化碳的性质,某同学设计了如图所示的实验: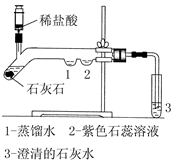
(1)写出石灰石与稀盐酸反应的化学方程式: 。
(2)用注射器注入稀盐酸,一段时间后,可观察到在1、2两处中有一处有明显的现象发生,该实验现象是 。
(3)3处的澄清石灰水变浑浊,这是由于 的缘故。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究一】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,催化效果如何?
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
| 实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
人教版新课标化学教材九年级上册 “分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁(Fe2O3)粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物进行分离,并将所得氧化铁粉末进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| Ⅳ分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
 (2)在第Ⅳ步实验中,可以用点滴板(如右图所示)代替试管C、D完成,
(2)在第Ⅳ步实验中,可以用点滴板(如右图所示)代替试管C、D完成,查看答案和解析>>
科目:初中化学 来源: 题型:探究题
实验室有三瓶失去标签的白色粉末,已知它们可能是碳酸钙、氢氧化镁、硫酸钾中的一种。请你设计实验把它们区别开来,并完成以下实验报告.
| 实验操作 | 预期现象与结论 |
| | |
| | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是: ,发生的反应方程式是: .
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
a:甲同学提出的猜想,立即遭到其他同学的反对,因为 ;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1﹣2滴酚酞试液,变红后 观察现象 | 溶液依然为红色 | |
| 实验步骤 | 实验现象 | 实验结论 |
| | | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫黄相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
[查阅资料]过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气.氢氧化钠能使无色酚酞试液变红色。
[设计实验]过氧化钠与水反应
[进行实验]
| 实验步骤 | 实验现象 | 结论 |
| 1.在试管中加入适量过氧化钠,再加入足量水; | 1.黄色粉末溶解,有 产生 | 产物 (填“有”或“没有”)氧气; |
| 2.用 伸入试管 | 2.木条复燃 | |
| ③再向试管中加入几滴酚酞试液. | | 产物有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
图中的各物质是初中化学常见物质。请根据图示回答: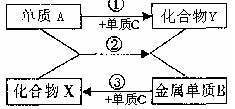
(1)化合物X中的元素共有 种;
(2)反应②的基本类型为 ;
(3)若常温下Y为无色液体,则A为 ;反应②的化学方程式可能为 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学课堂上同学们正在进行酸、碱、盐知识的探究,以下是教学片断,请你参与其中并认真填写空格.
【学生实验】将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
【学生板演】澄清石灰水变浑浊的原理 (用化学方程式表示)
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应
【实验探究】
(1)小华设计了如图所示的A、B两个实验.
实验现象:A中软塑料瓶変瘪,B中
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低.小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是 ,要得到科学严谨的结论,仍利用该装置,补做的对比实验是 .
(3)小宁设计的是通过检验生成物来验证猜想,请帮她填写实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 向B实验后的溶液中加入 | | 验证了二氧化碳和氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com