
| 温度/℃ 溶解度/g |
20 | 30 | 40 | 50 | 60 |
| 物质M | 32.2 | 37.4 | 40.4 | 50.4 | 55.2 |
| 氯化钠(NaCl) | 35.7 | 35.8 | 36 | 36.3 | 36.6 |

| 溶解度 |
| 100+溶解度 |
| 32.2g |
| 132.2g |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 温度/℃ 溶解度/g 物质 |
0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.5 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/ 溶解度/g 物质 |
0 |
10 |
20 |
30 |
40 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |

查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ 溶解度/g 物质 | 0 | 10 | 20 | 30 | 40 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:
某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:| 实验组号 | KNO3/g | H2O/g | 刚好出现晶体时的温度/℃ | 平均温度/℃ | 溶解度/g | ||
| 一 | 4 | 3 | 66.5 | 67.0 | 69 | 67.5 | 133.3 |
| 二 | 4 | 5 | 45.8 | 45.2 | 45.5 | 45.5 | |
| 三 | 4 | 7 | 32.5 | 33.0 | 33.0 | ||
| 四 | 4 | 9 | 27.8 | 27.3 | 27.0 | 27.4 | 44.4 |
| 五 | 4 | 10 | 25.8 | 30.1 | 26.1 | 40.0 | |

| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO3/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
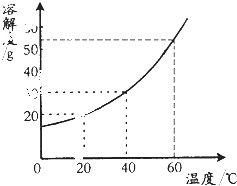 如图为某同学绘制的固体X的溶解度曲线,根据下表列出的部分数据判断X的选项是 如图为某同学绘制的固体X的溶解度曲线,根据下表列出的部分数据判断X的选项是
| ||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com