
 酸、碱、盐在我们的生活中有着重要作用.
酸、碱、盐在我们的生活中有着重要作用.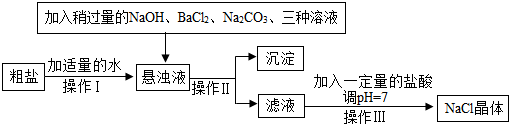
分析 (1)稀硫酸、氢氧化钠溶液、食盐水作用,三种物质分别为酸碱盐,根据性质差异选择可能的试剂就能把它们直接鉴别出来;
(2)稀盐酸与Ca(OH)2溶液能发生中和反应,取二者反应后的溶液,存在可能盐酸剩余或者碳酸钠剩余,或者两者恰好完全反应,根据给出的图进行分析解答;
(3)根据除杂的注意事项分析;
(4)根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钠的质量,进而求算其质量分数.
解答 解:
(1)稀硫酸、氢氧化钠溶液、食盐水,分别为酸、碱和中性的盐溶液,所以可以借助石蕊溶液来鉴别.也可以借助其他试剂,如 (NH4)2CO3或NH4HCO3 等.
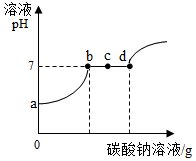
(2)①a点对应的溶液显酸性,说明先前的反应中有酸剩余,即盐酸与Ca(OH)2溶液反应后盐酸有剩余.
②c点是碳酸钠和氯化钙反应的过程,此时有生成的氯化钠和剩余的氯化钙,所以对应的溶液中的溶质是 NaCl、CaCl2.
③写出一个上述实验中反应的化学方程式 2HCl+Ca(OH)2═CaCl2+2H2O(之前的中和反应)或Na2CO3+2HCl═2NaCl+H2O+CO2↑(a--b段)或CaCl2+Na2CO3═CaCO3↓+2NaCl(b---d段).
(3)
①由于先前加入氯化钡除去硫酸钠时加入的氯化钡是过量的,所以在加入碳酸钠时应该稍过量的,这样在除去氯化钙的同时,将先前过量的氯化钡也除去.
②由于有生成的碳酸钙和碳酸钡、氢氧化镁和硫酸钡,所以一次性过滤操作Ⅱ时,得到的沉淀的成分有CaCO3、BaCO3和 Mg(OH)2、BaSO4.
③在操作Ⅲ是蒸发操作,在这个过程中玻璃棒不断搅拌,防止因局部温度过高,造成液滴飞溅.
(4)解:设50 mL溶液中含Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 0.44 g
$\frac{100}{44}$=$\frac{x}{0.44g}$
x=1.06 g
则500 mL溶液中含Na2CO3的质量为10.6 g
样品中氢氧化钠的质量分数为:$\frac{21.2g-10.6g}{21.2g}$×100%=50%
答:样品中氢氧化钠的质量分数为50%.
故答案为:
(1)石蕊溶液(或(NH4)2CO3或NH4HCO3 等);
(2)①盐酸与Ca(OH)2溶液反应后盐酸有剩余; ②NaCl、CaCl2;
③2HCl+Ca(OH)2═CaCl2+2H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑ 或CaCl2+Na2CO3═CaCO3↓+2NaCl;
(3)①除去多余的氯化钡; ②Mg(OH)2、BaSO4; ③搅拌,防止因局部温度过高,造成液滴飞溅.
(4)50%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:选择题
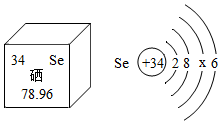 硒元素的部分信息如图所示.下列说法错误的是( )
硒元素的部分信息如图所示.下列说法错误的是( )| A. | 硒是非金属元素 | |
| B. | 硒元素的质子数为 34 | |
| C. | 硒的原子结构示意图中 x=18 | |
| D. | 在化学反应中,硒原子容易失去 2 个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
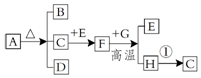
 已知ABCDE是初中化学常见的五种物质,其中A、D是黑色固体,B、C、E是无色气体,化合物D中含有金属元素,该金属元素的单质是世界年产量最高的金属.它们在一定条件下的转化关系如图所示(→表示转化).请回答下列问题:
已知ABCDE是初中化学常见的五种物质,其中A、D是黑色固体,B、C、E是无色气体,化合物D中含有金属元素,该金属元素的单质是世界年产量最高的金属.它们在一定条件下的转化关系如图所示(→表示转化).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
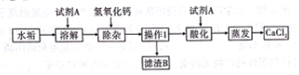
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该保鲜剂遇到碘盐会变蓝 | B. | 保鲜原理是使食品与氧气隔绝 | ||
| C. | 该保鲜剂可以与明火接触 | D. | 可以用任何易挥发的物质代替酒精 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲的化学式为NH3 | B. | 乙、丁都是氧化物 | ||
| C. | 丙中氮、氢原子个数比为1:2 | D. | 参加反应的甲、乙分子个数比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com