
【题目】以白云石(主要成分为CaCO3·MgCO3)为原料制备氢氧化镁的流程如下图:
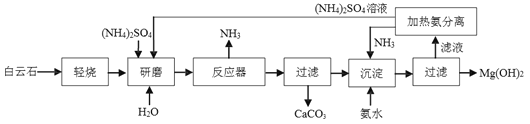
已知:①MgCO3![]() MgO+CO2↑,CaCO3
MgO+CO2↑,CaCO3![]() CaO+CO2↑ ;
CaO+CO2↑ ;
②反应器中发生的反应是(NH4)2SO4+MgO ![]() MgSO4+2NH3↑+H2O 。
MgSO4+2NH3↑+H2O 。
(1)实验室进行过滤操作时,玻璃棒的作用是____________________。
(2)该流程中,研磨的目的是____________________;轻烧的温度不超过__________℃,经轻烧得到的固体的主要成分是____________________(写化学式)。
(3)该流程中,不考虑H2O,可循环利用的物质是____________________(写化学式)。
【答案】 引流 增大反应物的接触面积,使反应更加充分 700 MgO、CaCO3 (NH4)2SO4、NH3 [或(NH4)2SO4、NH3·H2O]
【解析】(1)根据过滤时玻璃棒的作用是引流解答;
(2)反应物的接触面积越大,反应速率越快;根据流程,轻烧过程中,碳酸镁分解,而碳酸钙不分解,因此温度不应超过700℃;
(3)根据流程示意图可以判断能够循环利用的物质。
解:(1)实验室进行过滤操作时,玻璃棒的作用是引流;
(2)该流程中,研磨的目的是增大反应物的接触面积,使反应更加充分;轻烧的温度不超过700℃,经轻烧得到的固体的主要成分是MgO、CaCO3;
(3)该流程中,不考虑H2O,可循环利用的物质是(NH4)2SO4、NH3。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为测定铜与浓硫酸反应后残余清液中硫酸的溶质质量分数,提出了下列实验方案:
【查阅资料】Cu+2H2SO4(浓) Cu SO4+ SO2↑+2H2O
【实验设计】甲方案:将残余清液与足量BaCl2溶液反应,称量生成的BaSO4质量。
乙方案:将残余清液与足量锌粒反应,测量生成氢气的体积。
【分析交流】
(1)铜与浓硫酸反应中即使铜过量也不能将硫酸完全反应的原因是__________;
(2)甲方案是否可行?_________(填“可行”或“不可行”),理由是_________;
【实验探究】
(3)小王同学选用图2中的部分实验装置进行了乙方案的实验:
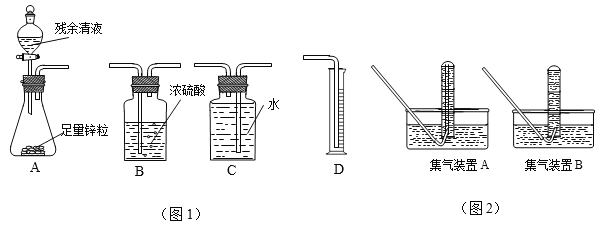
①你认为图1中最简易的装置及其连接顺序是:__________;
② 实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液
就不能顺利滴入锥形瓶。其原因是________;
③ 某学生想用排水法收集氢气并检验其纯度,应选择图2中的集气装置________(填“A”或“B”)。
(4)小张同学用如图3所示装置进行了乙方案的实验:
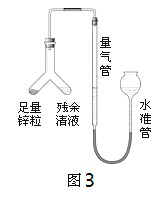
① 连接仪器,检查此装置气密性。下列能说明装置气密性良好的是________(填序号);
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平。
② 实验中残余清液与锌粒混合后的现象是锌粒逐渐溶解、_____、产生大量气泡,放出热量。
反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐渐减小的原因是___(排除仪器和实验操作的影响因素)。
④ 若实验中测得残余清液中硫酸的溶质质量分数偏大,下列可能的原因是________。
a.装置漏气
b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与我们的生活有着密切的联系。请在下列物质中,作出正确选择,并用序号填空。
①醋酸 ②甲烷 ③稀盐酸 ④石墨 ⑤干冰 ⑥氮气
(1)可用于生产铅笔芯的是_____;(2)一种家庭常用调味品中含有的成份_____;
(3)空气中含量最多的气体_____;(4)可用于金属除锈的是_____;
(5)可用于人工降雨的是_____;(6)天然气的主要成分是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl、KNO3、Ca(OH)2三种物质的溶解度曲线图如图一与图二所示,请回答:

(1)由图一可知,20℃时氯化钠的溶解度为 g.
(2)依据图一分析下列问题:50℃时,将氯化钠、硝酸钾固体各40g分别加入两只各盛有100g水的烧杯中,充分搅拌,其中 (填写物质化学式)得到饱和溶液;另一种物质的溶液中再加入 g该溶质,溶液恰好饱和;若将温度都降到20℃,硝酸钾溶液中溶质的质量分数 (填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数.
(3)依据图一分析,要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用先 再过滤的物理方法.
(4)如图三所示,20℃时,将盛有饱和石灰水的小试管放入盛水的烧杯中,向水中加入氢氧化钠固体,结合图二分析石灰水中可能出现 的现象.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在工业上,碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
【资料卡片】
(1)碳酸钠俗称纯碱、____。以纯碱和熟石灰为原料可以制烧碱,化学方程式为________。
(2)1921年,_______(填字母)发明了将制碱与制氨结合起来的联合制碱法,大大提高了原料的利用率。
A.拉瓦锡 B.道尔顿 C.侯德榜 D.张青莲
【定性实验】食盐是联合制碱法的主要原料之一,因此制得的纯碱中含有少量氯化钠。为了检验纯碱样品中存在氯离子,需要用到的药品是__________(填字母)。
A.氯化钡溶液 B.硝酸银溶液 C.稀硝酸 D.稀盐酸
【定量实验】将12.0g纯碱样品溶于水,加入足量氯化钡溶液,充分反应后,过滤、洗涤、低温干燥,得到19.7g沉淀。计算纯碱样品中碳酸钠的质量分数。__________(写出计算过程,结果保留一位小数)
【实验设计与评价】甲同学设计了如图实验装置,通过测量一定质量的纯碱样品与足量稀硫酸反应后产生二氧化碳的体积,进一步计算纯碱样品中碳酸钠的质量分数。

(1)检查装置的气密性时,起始状态量气管和水准管中液面相平,提高量气管,__________,证明该装置的气密性良好。
(2)乙同学认为该装置测得的二氧化碳的体积会偏小(不考虑操作上的失误),他的理由是______________________。
(3)丙同学认为该装置测得的二氧化碳的体积会偏大(不考虑操作上的失误),他的理由是______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图,回答有关问题:

(1)写出装置图中标号仪器的名称:①__________,②__________。
(2)实验室选用装置A作为氧气的发生装置,化学方程式为______________________;选用锌粒与稀硫酸反应制取氢气,化学方程式为______________________;氧气和氢气均可选用装置__________(填字母)作为收集装置。
(3)实验室选用大理石与稀盐酸反应制取二氧化碳,利用如图所示装置,可以得到纯净、干燥的二氧化碳。用化学方程式表示饱和碳酸氢钠溶液的作用:______________________;装置接口的连接顺序:发生装置→______,______→______,______→收集装置(填数字)。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有关实验现象的描述正确的是( )
A. 铁丝放入硫酸铜溶液中,表面出现红色的铜
B. 硫在氧气中燃烧发出蓝紫色火焰
C. 红磷在氧气中燃烧产生大量的白雾
D. 镁条在空气中与氧气反应,生成氧化镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com