
| A. | Mg | B. | Zn | C. | Cu | D. | Ag |
分析 A、B、C、D四个选项中依据金属活动性顺序,可判断C、D不与酸反应放出氢气,同质量镁、锌与酸反应时,镁比铁生成的氢气多,锌比铁生成的氢气少,假设5.6g全是铁时看生成的氢气量是多少,再结合前面的判断就可达到目的.
解答 解:5.6克纯铁片放在足量的稀盐酸中放出的氢气是0.18克,存在杂质导致生成的氢气的质量减少,即相同质量金属杂质比铁生成的氢气质量应该小于0.18g;
根据金属与酸反应产生H2的规律:H2的质量=金属的质量×$\frac{金属的化合价}{金属的相对原子质量}$,可知等质量的几种金属与足量酸反应产生的H2质量,该值越大,产生的H2质量越多,该值越小,产生的H2质量越小.
产生氢气的质量
Fe+2HCl═FeCl2+H2↑ $\frac{2}{56}$
Mg+2HCl═MgCl2+H2↑ $\frac{2}{24}$
Zn+2HCl═ZnCl2+H2↑ $\frac{2}{65}$观察数值,相同质量的铁、镁、锌与足量的稀盐酸反应,生成氢气的质量大小为:镁>0.2g>铁>锌;而铜、银不与酸反应;故锌、铜、银可能含有.
故选A.
点评 此题是利用假设的方法分析问题,采用的是平均值判断,结合了化学方程式的有关计算,训练了学生的思维.


科目:初中化学 来源: 题型:填空题
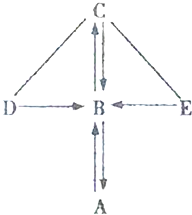 如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).
如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
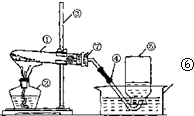 如图是实验室用加热高锰酸钾的方法制取氧气的实验装置图.
如图是实验室用加热高锰酸钾的方法制取氧气的实验装置图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com