将250g含杂质(杂质不参加反应,也不溶于水)40%的大理石放到500g稀盐酸中,恰好完全反应.求:
(1)生成二氧化碳多少克?
(2)所用稀盐酸的溶质质量分数是多少?
(3)所得溶液的溶质质量分数是多少?
解:样品中碳酸钙的质量为250g×(1-40%)=150g
设稀盐酸中溶质的质量分数为x,生成二氧化碳的质量为y,生成氯化钙的质量为z.
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑.
100 73 111 44
150g 500g×x z y
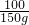
=
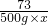
=
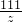
=
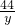
x=21.9%,y=66g,z=166.5g
所得溶液中溶质的质量分数为
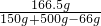
×100%≈28.5%
答:(1)生成二氧化碳的质量为66g.
(2)稀盐酸中溶质的质量分数为21.9%.
(3)所得溶液中溶质的质量分数为28.5%.
分析:由大理石的质量和含杂质的质量分数及稀盐酸的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出所用稀盐酸的溶质质量分数、生成二氧化碳和氯化钙的质量.
氯化钙的质量是所得溶液中溶质的质量;碳酸钙的质量与稀盐酸的质量和去掉生成二氧化碳的质量就是所得溶液的质量.由此根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.

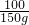 =
=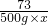 =
=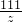 =
=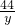
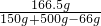 ×100%≈28.5%
×100%≈28.5%

 初中学业考试导与练系列答案
初中学业考试导与练系列答案