
【题目】用下图装置测定空气中氧气的含量。集气瓶的容积为350mL,瓶内预先装入50mL水。量筒内水的读数为100mL。
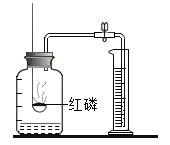
(1)红磷燃烧的化学方程式为________。
(2)若红磷量不足将导致的结果是_________。
(3)最终量筒内剩余46mL水,该实验测得空气中氧气的体积分数为_______%。
科目:初中化学 来源: 题型:
【题目】某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。请分析数据解答下列问题:
甲 | 乙 | 丙 | 丁 | |
所取固体样品的质量 | 25 | 25 | 20 | 20 |
加入硫酸溶液质量 | 50 | 100 | 100 | 120 |
反应剩余固体质量 | 21 | 17 | 12 | 12 |
(1)四位同学中, 同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙” 或“丁”中选择填写);
(2)混合物氧化铜的质量分数为?
(3)硫酸溶液中溶质的质量分数为?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4较多的CuSO4少量的Na2SO4以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
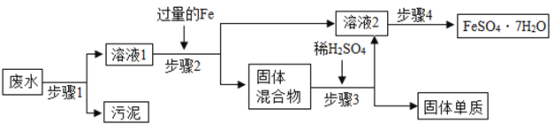
(1)步骤1、步骤2、步骤3的主要操作是相同的,需用到的玻璃仪器除烧杯和玻璃棒外还有_____。
(2)步骤2中发生反应的化学方程式为_____。
(3)步骤3中发生反应的化学方程式为_____。
(4)步骤4中涉及的操作是:蒸发浓缩、降温结晶、过滤、洗涤、烘干,过滤后滤液中还存在的金属阳离子有_____。
(5)最后的固体单质是_____(填名称)
(6)若测得某溶液中仅有钠离子、镁离子、硫酸根离子、氯离子这四种离子,已知钠离子、镁离子、氯离子个数之比为4:5:8,若钠离子为4n个,则硫酸根离子的个数是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】活性炭内部有许多微细孔隙,可用于脱色,脱色原理的微观示意图如图。实验小组对活性炭使有色物质褪色进行探究。
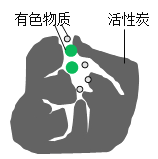
(猜想假设)有色物质的微粒被吸附在活性炭孔隙里,从而褪色。
(查阅资料)
i.品红溶液、水果口味汽水、红墨水等溶液中均含有有颜色的有机物。有机物是指含碳元素的化合物,但不包括碳的氧化物、碳酸和碳酸盐。
ii.高锰酸钾(KMnO4)为无机物,其水溶液为紫红色。MnSO4可以与铋酸钾反应生成KMnO4。
(进行实验)
将下列5种溶液,各取20 mL,依次倒入5个相同的自制活性炭净水器中,如图,放置相同时间,打开活塞,观察溶液颜色,现象见下表。
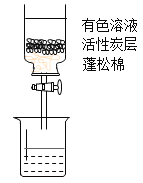
实验编号 | ① | ② | ③ | ④ | ⑤ |
有色溶液 | 品红溶液 | 橙味汽水 | 红墨水 | 酸性KMnO4溶液 | CuSO4溶液 |
现象 | 红色溶液褪为无色 | 橙黄色溶液褪为无色 | 红色溶液褪为无色 | 紫红色溶液 褪为无色 | 蓝色溶液 无明显变化 |
(结果讨论)
(1)在上述实验①~⑤中,活性炭更容易使有颜色的______(填“无机物”或“有机物”)褪色。
(2)若用紫色葡萄味汽水做上述实验,可以观察到的现象是______。
(3)已知品红溶液中有色物质微粒直径d约为1.0 nm,结合猜想推测品红溶液褪色的原因:活性炭孔隙直径D_____(填“≥”或“≤”)d,有色物质的微粒被吸附在活性炭孔隙里,从而褪色。
(深入探究)小组同学对酸性KMnO4溶液的褪色产生兴趣并继续探究。
(4)KMnO4是自身见光分解了吗?有同学发现高锰酸钾溶液盛放在棕色试剂瓶中,而棕色试剂瓶用于盛放见光易分解的化学药品,由此猜测高锰酸钾溶液可能在进行实验④时由于见光分解而褪色。小康同学设计了合理的对照实验证明这个猜测不成立。
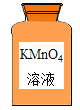
实验方案:取20 mL相同浓度的酸性KMnO4溶液,______,放置相同时间,溶液颜色无明显变化。
(5)KMnO4是与活性炭发生反应了吗?
老师查阅文献:活性炭能与酸性KMnO4溶液发生反应,生成几乎无色的MnSO4,从而使溶液褪色。小组同学设计实验:取实验④出水口的溶液于试管中,向其中加入试剂X。预设观察无色溶液是否变为紫红色。则试剂X是______。
(实验反思)
(6)活性炭使有色物质褪色时发生的变化可能有______(填“物理”或“化学”或“物理和化学”)变化。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请从A~D中任选三个作答,若均作答,按前三个给分。
序号 | 目的 | 操作 | 现象 | 结论 |
A | 鉴别氯化钠和碳酸钠 |
| 试管1中无明显现象, 试管2中产生气泡 | 试管1中固体为氯化钠,试管2中固体为碳酸钠 |
B | 比较铜、银的金属活动性 |
| _______ | 铜的金属活动性比银强 |
C | 探究水的组成 |
| 正极产生气体能使带火星木条复燃,负极产生气体能燃烧,发出淡蓝色火焰 | _______ |
D | ______ |
| 左侧集气瓶中溶液无明显变化,右侧集气瓶中溶液变浑浊 | 呼出气体中二氧化碳含量高于空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧气的化学性质比较活泼,能与多种物质反应.下列对有关反应的描述正确的是( )
A.在点燃的条件下,细铁丝在氧气中剧烈燃烧,火星四射,生成黑色的三氧化二铁
B.在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成无色无味的气体
C.铁、硫、甲烷在氧气中的燃烧都是化合反应
D.物质与氧发生的反应属于氧化反应,氧气具有氧化性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)实验室制取氧气所需装置如图所示,回答下列问题:
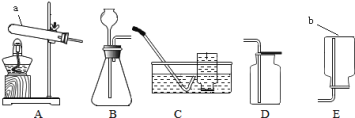
(1)写出仪器名称:b
(2)用过氧化氢溶液和二氧化锰制取氧气时,其反应的化学方程是 .选用的发生装置是 (填序号),实验结束后装置内得到的物质属于 (填“纯净物”或“混合物”),此外还可以用 色的高锰酸钾来制取氧气,收集时若用C装置,收集的最佳时机是 .
(3)某兴趣小组查阅资料知:氧化铁也可以作双氧水制取氧气的催化剂,那么氧化铁和二氧化锰这两种物质哪一种更适合呢?他们在探究二氧化锰、氧化铁对过氧化氢分解速率的影响时,他们在控制变量的问题上提出了不同的观点,你认为正确的是 (可以多选)。
A.双氧水的浓度一定相同 B.催化剂的质量一定相同
C.反应前双氧水的温度一定相同 D.反应容器的容积一定相同.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠是重要的化工原料。吕布兰、索尔维和侯德榜为它的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法:1789年,法国医生吕布兰(N. Leblanc, 1742 -1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
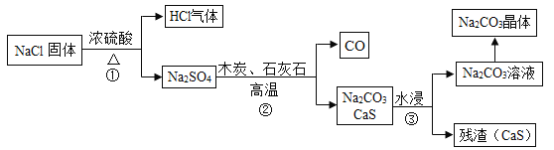
(1)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为____;
(2)③中”水浸”时通常需要搅拌,其目的是____;
(3)吕布兰法有明显不足,不断有科学家进行改进,请写出该法不足之处__(一处即可)。
II、索尔维法: 1892 年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
![]()
![]()
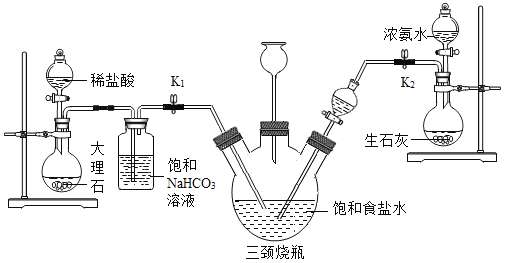
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。实验操作如下:
①关闭K1,打开K2,通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭 K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(4)三颈烧瓶上连接的长颈漏斗的主要作用是_______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通CO2一段时间,其目的是_______;
(5)根据实验记录,计算t2时NaHCO3固体的分解率为______( 已分解的NaHCO3质量与加热前原NaHCO3质量的比值)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分别向装有等量的水的A、B、C烧杯中分别加入10g、20g、25g某种固体,充分溶解后,现象如图一所示。
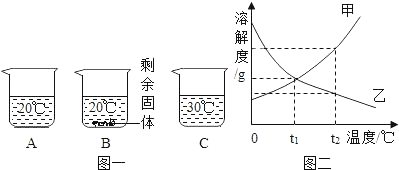
①三个烧杯中溶质质量分数最大的溶液_____(填“A”“B”或“C”)
②烧杯A、B、C中的溶液一定属于饱和溶液的是_____(填“A”“B”或“C”)。
③图二中能表示该固体溶解度曲线的是_____(填“甲”或“乙”)。
④由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的_____(填序号)。
A 甲、乙都是饱和溶液 B 所含溶剂质量:甲<乙
C 溶液质量:甲>乙 D 溶质质量分数:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com