
【题目】二氧化碳在一定条件下可转化为重要的化工原料乙烯,其反应的微观过程如下图所示。
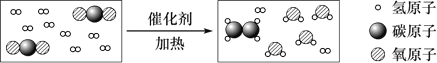
下列有关叙述中正确的是
A. 反应有单质生成 B. 乙烯中碳元素的质量分数小于甲烷中碳元素的质量分数
C. 反应前后原子种类和数目均不变 D. 参加反应的两种分子的个数比为4∶1
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】氯化铵、硫酸钾是常见的化肥,请回答下列问题:
(1)氯化铵的化学式______;
(2)铵根离子______(填写离子符号),其氮元素化合价为______;
(3)铵态氮肥不能与碱性肥料混合施用。氯化铵与氢氧化钠溶液共热反应的化学方程式为____。碳酸氢铵应避免在气温较高时使用,其受热分解的化学方程式为________。碳酸氢铵还能与盐酸反应,其化学方程式为________;
(4)下列物质属于复合肥的是____________;(填写字母)
A.氯化铵 B.硝酸钾 C.磷酸二氢铵 D.硫酸钾
(5)氮肥中的“氮”指的是____________。(填写字母)
A.单质 B.元素 C.原子 D.分子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验操作技能越来越受重视,下列实验操作不正确的是
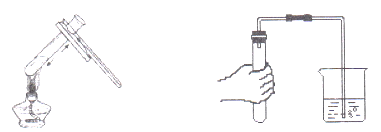
A. 加热液体 B. 检查装置气密性
C. 浓硫酸溅到皮肤上,立即用大量水冲洗,再涂上3%~5%的小苏打溶液 D. 配制50克5%的NaCl溶液时,把称好的固体倒入到量好水的量筒中进行溶解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了维护南海权益,我国在2012年宣布成立了三沙市。这是维护国家主权的象征,同时也是因为海洋资源十分丰富,有广泛的利用价值。其中通过海水晾晒即可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:

(1)根据以上信息,请写出海水中所含的主要阴离子的符号___________。
(2)在上述流程中第③步加过量NaOH的目的是除去海水中的________(填离子符号,下同),第④步加过量Na2CO3的目的是除去海水中和所加入试剂中的_____。第⑥步其实显示的是加适量盐酸,其目的是除去多余的___________ 。
(3)在第④步操作中,选择的除杂试剂不能用K2CO3代替Na2CO3,理由是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某地规定:工业排放的气中SO2的含量不超过0.4mgL-1,某兴趣小组利用反应SO2+l2+2H2O=H2SO4+2HI,测定某工业废气中SO2的含量,测试装置如图所示。
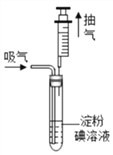
测试步骤:
①碘溶液的配制:准确称取1.27g碘单质,加入少量碘化钾,先溶解在100mL水中,续加水配制成1000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液,溶液变蓝。
③把100mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。然后缓缓向外拉注射器,每次抽取的气体为100mL,重复抽取n次,直到溶液变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)步骤②中,5mL溶液中溶有碘单质_______mg,步骤③中缓缓向外拉注射器,“缓缓”的目的是_______,
(2)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色,试计算该废气中SO2含量,并判断是否符合排放标准。__________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料在日常生活中应用广泛。
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应________(填“放热”或“吸热”),反应的化学方程式为___________。
(2)金属钨(W)可做灯泡的灯丝。用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4。化学方程式为 4FeWO4 + 4Na2CO3 + O2 ![]() 4Na2WO4 + 2Fe2O3 + 4______。
4Na2WO4 + 2Fe2O3 + 4______。
(3) 合金有很多性能与组成它们的纯金属不同。下图中能表示锡铅合金的是____(填序号“a”“b”或“c”)。
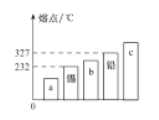
(4)合金材料 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]是一种新型塑料阻燃剂,其中a、b、c、d的代数关系式:2a+3b=_________________________________。
(5)向某硫酸铜溶液中放入一定量的铝铁合金,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生。则滤液中一定发生的反应化学方程式为______________,反应类型为___________反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们可以通过下列方式认识空气。
①空气中体积分数约为78%的物质是_____。
②为测定空气中氧气的体积分数,设计如图实验。
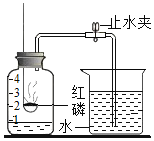
Ⅰ.为了确保实验成功,在装药品之前应该检查装置的__________。
Ⅱ.该实验中红磷需要过量的原因是___________。
Ⅲ.红磷燃烧的现象是_____,反应的化学方程式_____________。
Ⅳ.冷却至室温后打开止水夹观察到的现象是____________。由此得出空气中氧气的体积分数约为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
![]()
[查阅资料]
I.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式如下:Na2O + H2O = 2NaOH 2Na2O2 + 2H2O = 4NaOH + O2↑
II. CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液或Ca(OH)2溶液发生复分解反应;
碳酸钠溶液与盐酸反应方程式有:Na2CO3 +HCl=NaHCO3 +NaCl、Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________________ | __________________________ | 产物为Na2O |
⑵ 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验过程]
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量_______; | _______ | 猜想3成立 |
②过滤,取少量滤液滴入________________。 | _________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)根据硝酸铵的化学式进行计算
①硝酸铵的化学式量___________
②硝酸铵中氮元素、氢元素、氧元素的质量比__________
③硝酸铵中氧元素的质量分数__________
(2)将80g溶质的质量分数为20%硝酸钾稀释成5%,需加水多少_______g?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com