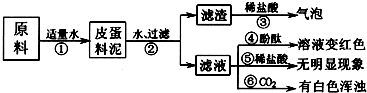
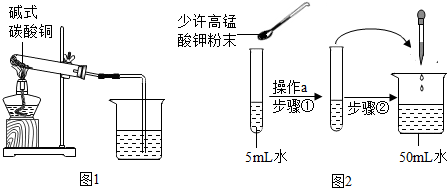
某校的化学学习小组根据下面给出的药品和实验装置,设计一个实验,粗略测定由铜和锌两种金属组成的合金-黄铜中锌的质量分数(黄铜已加工成粉末).实验装置如图(另有托盘天平可用):
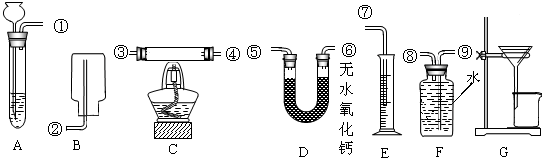
【药品】稀硫酸、浓硫酸、氧化铜
【分析与思考】同学们通过充分“交流-分析-讨论”后一致认为,设计以下三种实验方案可测出黄铜中锌的质量分数.
C装置中,提供热源的仪器名称是
,三种方案都必需选用的药品是
.
同学们用过量该药品与称取的ag黄铜粉样品进行充分反应后,实验中测定了以下数据:
①测定生成H
2的体积bL(已知氢气的密度);
②过滤、洗涤、烘干后,测定漏斗中剩余固体的纯净质量为Cg;
③充分反应后,测定A装置中仪器和药品总质量减少了d克.
【方案一】小悦同学仅选用一个实验装置A进行实验,用测定数据③,通过计算可求出黄铜中锌的质量分数为(写计算结果)
.在装置A中发生反应的化学方程式为
.
【方案二】小华同学选用两个装置
(填装置编号,以下同)进行实验,并用测定数据
(填数据编号,以下同),通过计算也求出了黄铜中锌的质量分数.
【方案三】小琳同学选用三个实验装置进行实验,装置连接的顺序是(用装置接口处的编号表示)
,并用测定的数据
,通过计算也求出了黄铜中锌的质量分数.
【反思与评价】同学们对上述三种实验方案进行了综合评价,一致认为方案
简单易行.




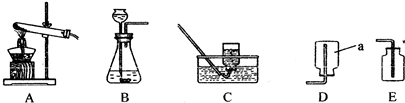
 某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.