(2008?扬州)无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
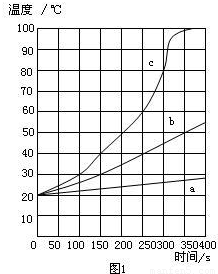
实验1:Ⅰ、将一定质量的镁条、铁粉和氯化钠加入盛有100mL水的隔热容器中,连续搅拌,每50s记录一次温度,得图1中曲线a;
Ⅱ、将相同质量的镁条剪成100份代替Ⅰ中镁条重复以上实验,得图1中曲线b;
Ⅲ、用相同质量的镁粉代替Ⅰ中镁条重复以上实验,得图1中曲线c.
(1)从能量变化角度看,该变化是由
化学
化学
能转化为
热
热
能.
(2)观察图1,从中可以发现影响镁和水反应速率的因素是
镁的反应表面积
镁的反应表面积
.
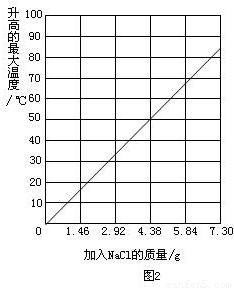
实验2:将2.4g镁粉和质量为28g的铁粉混合,加入盛有100mL水的隔热容器中,不断搅拌.氯化钠用量不同时,温度变化
随氯化钠的量的增加而增大
随氯化钠的量的增加而增大
情况如图2所示.

(3)实验2中,当NaCl质量大于7.31g时,实验不再做的原因是
C
C
.
A.加入更多的NaCl不再增加反应速率
B.加入更多的NaCl会降低反应速率
C.已达到水的沸点,温度不会再有变化
D.需加入更多的铁粉来提高水的温度
(4)如果在实验2中加入质量为3.65gNaCl,混合物的温度最高大约是
58~63℃之间
58~63℃之间
.
(5)某同学设计了下面四种无焰食品加热器物料配方,请根据本次实验研究的结论,判断其中最合理的是
A
A
.
A.2.4g镁粉、7.30g NaCl和28g铁粉 B.2.4g镁条、7.30g NaCl和28g 铁粉
C.2.4g镁粉、8.76g NaCl和28g铁粉 D.2.4g镁条、8.76g NaCl和28g铁粉
其理由是
镁粉比镁条能更快产生热量,配方A中已达到水的沸点,配方C中多余的NaCl造成原料浪费
镁粉比镁条能更快产生热量,配方A中已达到水的沸点,配方C中多余的NaCl造成原料浪费
.