
| A. | 44% | B. | 46% | C. | 50% | D. | 55% |
分析 碳酸钾和碳酸钙的固体混合物23.8g,与200g质量分数为7.3%的盐酸恰好反应,根据元素质量守恒,可用稀盐酸中氯元素的质量进行计算.
解答 解:碳酸钾、碳酸钙与稀盐酸反应的化学方程式分别为CaCO3+2HCl═CaCl2+H2O+CO2↑、K2CO3+2HCl═2KCl+H2O+CO2↑,由上述化学方程式可知,碳酸钾、碳酸钙与盐酸恰好反应后,生成氯化钙和氯化钾,根据元素质量守恒,氯化钙和氯化钾中氯元素的质量即为稀盐酸中氯元素的质量,即:200g×7.3%×$\frac{35.5}{36.5}×100%$=14.24g,故混合物中金属元素的质量为26g-14.24g=11.76g,则原混合物中金属元素的质量分数为$\frac{11.76g}{23.8g}×100%$=50%.
故选:C.
点评 本题难度较大,掌握反应前后氯元素的质量不变是正确解答本题的关键.


科目:初中化学 来源: 题型:推断题
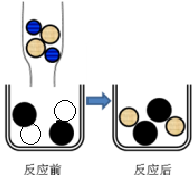 向硫酸铜溶液中滴加氢氧化钠溶液至恰好完全反应.
向硫酸铜溶液中滴加氢氧化钠溶液至恰好完全反应. Na+
Na+  Cu2+
Cu2+  SO42-
SO42-查看答案和解析>>
科目:初中化学 来源: 题型:解答题
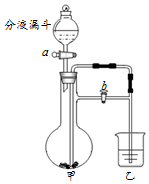 化学小组同学利用如图装置分别完成2个实验.
化学小组同学利用如图装置分别完成2个实验.| 序号 | 甲 | 乙 | 分液漏斗 |
| 1 | 大理石 | 澄清石灰水 | 稀盐酸 |
| 2 | 二氧化锰 | 80℃热水及一小块白磷 | 过氧化氢溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 操作方法 |
| A | NaCl(KNO3) | 冷却热的饱和溶液 |
| B | FeCl2(CuCl2) | 加入足量铁屑,充分反应后过滤 |
| C | CO2(HCl) | 气体依次通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
| D | Na2SO4(Na2CO3) | 加盐酸至恰好不再产生气泡为止 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 材料对我们的生活影响越来越大
材料对我们的生活影响越来越大查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com