
��11�֣�ijУ��ѧ��ȤС��ι��Ƽ���������Ϣ���������������о���
����Ʒ��ԭ����
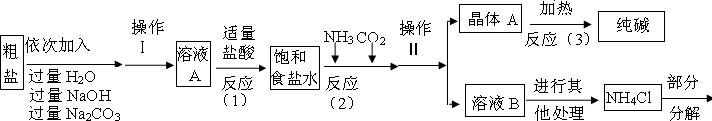
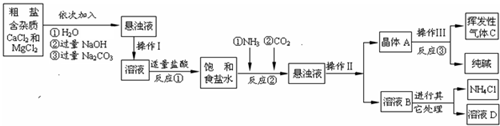
�ó����á������Ƽ������������Ʒ�������Na2CO3���ͻ���NH4Cl��
����ԭ���ǣ���NH3��CO2ͨ�뱥��ʳ��ˮ�еõ�NaHCO3��NH4Cl�Ļ�����ӦΪ��
NaCl�����ͣ�+ NH3 + CO2 + H2O = NaHCO3��+ NH4Cl�������NaHCO3�������Ƶô��
���������̡�

��������ϡ�
�� NH4Cl NH3��+HCl��
NH3��+HCl��
�� ��֪20��ʱ�й����ʵ��ܽ�����£�����ָ1���ˮ�����ܽ�����������
|
���� |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
|
�ܽ�� |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
���������ۡ���
�� �����������Ϊ ��
�� ��Ӧ���з�����������Ӧ��д�����е�һ����ѧ����ʽ��
��
�� ��Ӧ���еõ�����Ļ�ѧ����ʽΪ�� ��
�� ��ҺB�е������� ������д�����֣���
�� �������������п�ѭ��ʹ�õ��� ������ţ���
A.�ӷ������� B.��Һ C.������þ D.����NH4Cl
�����ȷ����
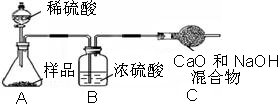
�� ��ȡһ�������Ĵ�����Ʒ������γ�ּ��Ⱥ��ٳ��أ������ޱ仯��
�� ��ȡ����������Ʒ��������ˮ����Ʒ��ȫ�ܽ⣬�����Һ�м������ϡHNO3���ٵμ�AgNO3��Һ���а�ɫ������
������ʵ���ȷ��������Ʒ�������� ��д��ѧʽ����
�������ⶨ��
��ȡ������Ʒ10.8g��������ˮ,�ټ������CaCl2��Һ�����衢���ˡ�ϴ�ӡ������Ƶù�������Ϊ10.0g����ͨ�����㲢����ұ��жϴ˴�����Ʒ�ȼ�Ϊ Ʒ��������̣�
���ܽᷴ˼��
ijͬѧ��Ϊ��������������ⶨ�У���CaCl2��Һ��ΪBaCl2��Һ���ⶨ�����С���������� ��
�������ۣ�1������
��2��HCl + NaOH = NaCl + H2O �� Na2CO3 + 2HCl = 2NaCl + CO2 ��+ H2O
��3��2NaHCO3 = Na2CO3 + CO2 ��+H2O
(4) NH4Cl�� NaHCO3 ��NaCl ��NH4HCO3������2��
��5��AB ����ɲⶨ��NaCl��
�����ⶨ;���㺬��Ϊ98.1% ���ȼ����ϸ�
�ܽᷴ˼��ͬ����������Ʒ��Ӧ�õ���BaCO3��������CaCO3 ������Խ����������ԽС��
��������[��������]��
��1������С����������Һ�����γɵĻ���������Һ����ʹ����Һ��Ϊ��Һ���ɹ��˵����еIJ�����ʲ�������ͬ����������Ϊ����;
��2����ͼ��֪����Ӧ���������ᷴӦ��������NaOH��Na2CO3���ʷ�Ӧ����ʽΪ��NaOH+HCl�TNaCl+H2O��Na2CO3+2HCl=2NaCl+H2O+CO2��
��3����ͼ��֪������AΪNaHCO3�����Է�Ӧ���еõ�����Ļ�ѧ����ʽΪ��2NaHCO3 = Na2CO3 + CO2 ��+H2O;
(4)��ͼ��֪����ҺB�е�������NaHCO3��NaCl��NH4Cl��NH4HCO3���֣��ʴ�Ϊ���е���������;
��5���ӷ�������C�Ƕ�����̼����ҺD�ǿ��ܺ���NaCl�ȶ������ʵĻ�����Ϊ��������Ϣ�������ж��������ɣ���������̼���Ȼ������������������ж�����ѭ��ʹ��
[���ȷ��]
��2���������֪���μ�AgNO3��Һ���а�ɫ�������˳�����AgCl�����Է�Ӧ����һ����Cl���ӣ��������֪�������Һ�м������ϡHNO3��Ӧ�������Ʒ��ȫ����ˮ���ɴ˿����ƶϴ�����Ʒ��������NaCl����1�֣�
[�����ⶨ]
�⣺��Na2CO3������Ϊm
Na2CO3+CaCl2=CaCO3��+2NaCl��1�֣�
106 100
m 10.0g
106��100=m��10.0g
��ã�m=10.6g��1�֣�
10.6g /10.8g��100%��98.1%���빤ҵ��������գ����ںϸ�Ʒ��
���ܽᷴ˼����������̼�������Ȼ�����Ӧ������̼�ᱵ������������ʱ�ģ���ԣ����С


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ
С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ���� | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| �ܽ�� | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| ʵ��һ | ʵ��� | ʵ���� | ʵ���� | |
| ����������Һ���� | 100g | 100g | 100g | 100g |
| ����CaCl2��Һ���� | 10g | 20g | 30g | 40g |
| ���ɵij��������� | 4g | m | 10g | 10g |
| ��ҵ���������Na2CO3% �� | |||
| �ŵ�Ʒ | һ��Ʒ | �ϸ�Ʒ | ��Ʒ |
| ��95 | ��80 | ��75 | ��40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ���� | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| �ܽ�� | 36.0g[ | 9.6g | 37.2g | 710 | 0.9 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||

| ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� |
������ɫ���ݣ�����ʯ��ˮ����� ������ɫ���ݣ�����ʯ��ˮ����� |
����Ʒ��NaHCO3������Na2CO3 ����Ʒ��NaHCO3������Na2CO3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com