
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验 步骤 |
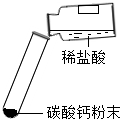 |
 |
 |
| 现象 | 剧烈反应,产生大量气泡,反应迅速停止 | 产生气泡,速率迅速减慢,反应几乎停止. | 产生气泡,反应持续时间较长 |
| 分析 | 反应速率过快,气体不便收集 | 无法持续产生CO2 | 速率适中,便于收集气体 速率适中,便于收集气体 |
| 结论 | 实验室制取二氧化碳的原料是 块状大理石和稀盐酸 块状大理石和稀盐酸 . | ||
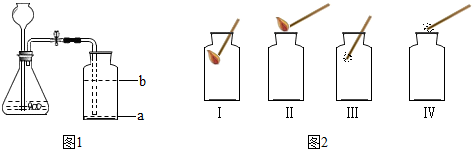
查看答案和解析>>
科目:初中化学 来源: 题型:
| 32 | 34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com