
【题目】下列变化属于化学变化的是( )
A. 金刚石制成钻石
B. 石墨制成金刚石
C. 木炭使二氧化氮气体褪色
D. 石墨导电
科目:初中化学 来源: 题型:
【题目】控制变量,设计对比实验是实验探究的重要方法。
实验 | 一、探究人体呼出气体中二氧化碳含量比空气中的高 | 二、探究影响品红扩散快慢的因素 | 三、铁钉锈蚀条件的探究 |
实验 |
|
|
|
实验 | 本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制 相同。 | 发现两杯水都变红,且整杯热水变红时间比冷水要短。由此说明:①分子在不断运动;②影响分子运动快慢的因素有 。 | 一周后,左边试管中铁钉生锈,右边试管中铁钉无明显变化。上述实验 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取气体所需的装置如图所示.
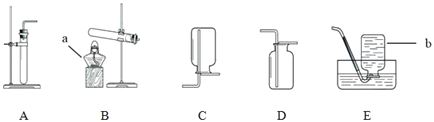
(1)写出仪器名称:a__,b__.
(2)实验室用高锰酸钾制取氧气,反应的化学方程式为__.选择的发生装置是__(填序号,下同);用过氧化氢溶液制取氧气的化学方程式为__.若要收集到干燥的氧气,收集装置是__,其验满方法为__.
(3)用装置E收集氧气时,下列实验操作正确的是__(填序号).
a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
b.加热后,观察到水中导管口开始有气泡时,立即收集气体
c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
d.排水法收集完氧气后,先熄灭酒精灯,再将导气管从水槽中移出
(4)实验室中可以用加热氯化铵和氢氧化钙固体混合物的方法制得氨气.氨气极易溶于水,且密度小于空气.实验室中制取氨气的发生和收集装置为__.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图表示研究人体吸入空气与呼出气体成分差异的实验装置
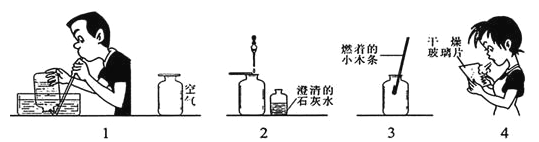
(1)将燃着的小木条分别放入吸入空气和呼出气体的集气瓶中,现象是____________,由此得出的结论是人体呼出的气体中________________含量比吸入空气中少;
(2)对着干燥的玻璃片哈气,现象是____________________,由此得出的结论是人体呼出的气体中________________含量比吸入空气中多。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关金刚石、石墨、C60、木炭的说法错误的是( )
A. 金刚石是天然存在最硬的物质
B. C60是一种新型的化合物
C. 石墨具有优良的导电性,可用作电极材料
D. 木炭疏松多孔,具有吸附能力
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从下列物质中选出其主要用途:①金刚石;②石墨;③C60;④焦炭。
(1)可用作切割大理石的是(填序号,下同)______;
(2)可作润滑剂的是______;
(3)可作燃料和冶金的是______;
(4)应用于材料科学、超导体领域的是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢气和氧气的混合气体共5 g,点燃,使它们充分反应后恢复到室温,生成4.5 g的水,关于原混合气体的说法中正确的是( )
①可能是2.5 g氢气和2.5 g氧气
②可能是1 g氢气和4 g氧气
③可能是0.5 g氢气和4.5 g氧气
④可能是0.5 g氢气和4 g氧气
A. 只有①正确 B. 只有②③正确
C. ①②③都正确 D. 只有④正确
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于______(填序号)。
A.无机材料 B.合成材料 C.复合材料 D.复合肥
(2)铜绿分解的化学方程式为_____________________。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“![]() ”为铜片)。
”为铜片)。

实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管______(填试管编号)。
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
(4)上述两种方法中,你认为哪种方法更好________,原因是__________(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S80%的辉铜矿_____t(取整数)。
三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
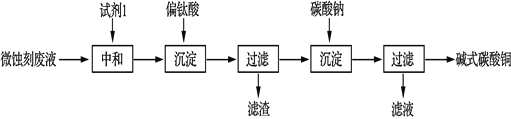
(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用______(填序号)。
a.Fe2O3 b. CaCO3 c.CuO
(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5____ 。
(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_________。
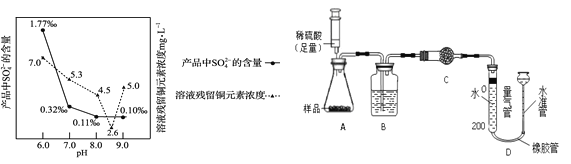
(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如右上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:①连接装置并_______;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是____,少量植物油的作用是______,C中的试剂是_____(填字母序号);
a.碱石灰 b.浓硫酸 c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管_____(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_________。(保留到0.1%)
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是______(填字母序号);
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油
D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。
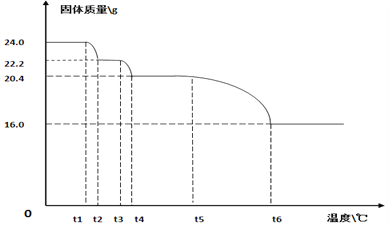
(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z=_________ ;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com