
某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO4·XH2O)。
查阅资料:
Ⅰ 过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
Ⅱ CuSO4·XH2O易溶于水难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO4。
Ⅲ 白色粉末CuSO4易与水化合生成CuSO4·XH2O
I、硫酸铜晶体的制备
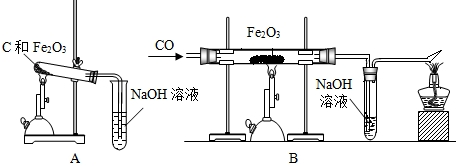
方案1:毛毛同学根据已学知识,提出了制备硫酸铜方案:

方案2:方舟同学查阅资料归纳了一种工业制备硫酸铜的流程:

(1)上述方案1中加热搅拌的作用是 ,形成蓝色溶液的化学反应方程式是: 。
(2)方案2中,加入H2O2后要求温度控制在50℃到60℃是为了防止 。
(3)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(4)方案中“一系列操作”依次为:过滤、、冷却结晶、(填序号)。
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都是CuSO4的 (选填“饱和”、“不饱和”或“不一定饱和”)溶液,向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 。
⑹所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是 。
A.冷蒸馏水 B. 95%的酒精 C.热蒸馏水
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定

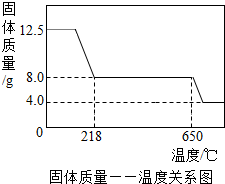
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量一温度的关系图。
(7) 258℃时,固体完全变成白色粉末。根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程,3分)
(8)加热过程中,硫酸铜晶体分步失去结晶水。请写出45℃到110℃时反应方程式
(9) 580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
⑴加快反应速率 CuO+H2SO4==CuSO4+H2O
⑵H2O2受热分解
⑶ 2 避免灼烧废料产生的污染
⑷ A D
⑸饱和 CuSO4+H2O ==CuSO4·XH2O 硫酸铜粉末与水化合后,饱和溶液中溶剂减少
⑹B
⑺5
⑻CuSO4·4H2O CuSO4·H2O+3H2O↑
CuSO4·H2O+3H2O↑
⑼2CuSO4 2CuO+2SO2↑+O2↑
2CuO+2SO2↑+O2↑
【解析】
试题分析:I 、(1)在方案1中,由于加热可增加反应物分子的运动速率,搅拌会使反应物混合更均匀,故可增加反应物相互接触的机会,因此加热搅拌的作用是加快反应速率;根据题意分析,形成蓝色溶液的现象的反应是氧化铜与硫酸反应,生成硫酸铜和水,故化学反应的方程式是CuO+H2SO4=CuSO4+H2O。
(2)根据资料可知,“对过氧化氢的水溶液加热、光照或加催化剂(如MnO2)都会促进其分解”,故在方案2中,加入H2O2后要求温度控制在50℃到60℃,是为了防止其受热分解。
(3)从环保的角度分析可知,由于甲方案的第一步是灼烧,会产生一些污染空气的气体,粉尘,烟雾等,即会污染空气,由此可知方案2更合理。
(4)根据图示,结合已有的部分操作步骤分析,因为过滤后的滤液要进行冷却结晶,故需先进行蒸发浓缩A,这样才好对其冷却结晶;又由于最终要得到的是硫酸铜晶体,故结晶后还需过滤D、洗涤和干燥等。
(5)根据图示,溶液M、N都是析出硫酸铜晶体后的溶液,即均不能继续溶解硫酸铜,故均属于硫酸铜的饱和溶液;向硫酸铜的饱和溶液中加入无水CuSO4,由于硫酸铜粉末能与水化合,故饱和溶液中的溶剂会减少了,则会有相应的溶质的析出。
(6)根据资料可知,CuSO4·XH2O易溶于水难溶于酒精,故可用少量95%的酒精洗涤硫酸铜晶体,这样可减少硫酸铜晶体因溶于水而有部分损失。故选B
II、(7)根据资料,CuSO4·XH2O加热时会逐步失去结晶水,最终生成CuSO4,结合题意,“258℃时,固体完全变成白色粉末”,说明此时硫酸铜晶体(CuSO4·xH2O)已完全分解生成硫酸铜和水,则该反应可表示CuSO4?xH2O△CuSO4+xH2O;再结合图中数据可知,258℃时,剩余固体质量为8g,则根据胆矾晶体受热分解的化学方程式和胆矾与硫酸铜的质量,以及它们之间的固定质量比,就可计算出胆矾晶体中x的值。
CuSO4?xH2O△CuSO4+xH2O
160+18x 160
12.50g 8g
(160+18x):160=12.50g:8g
解得,x=5
(8)根据题意,加热过程中,硫酸铜晶体会分步失去结晶水,故可将反应表示为CuSO4?5H2O△CuSO4?mH2O+(5-m)H2O;结合图中数据可知,45℃时,剩余固体质量为11.6g,则根据反应的方程式和两固体的质量、以及质量比,可计算出其中m的值。
CuSO4?5H2O△CuSO4?mH2O+(5-m)H2O
250 160+18m
12.5g 11.6g
250:(160+18m)= 12.5g:11.6g
解得,m=4,
即此时所得晶体为CuSO4?4H2O;
同理,根据图中数据110℃时,剩余固体质量为8.9g,同样可计算出所得晶体中所含结晶水的量,可设所得晶体为CuSO4?nH2O,则有
CuSO4?5H2O△CuSO4?nH2O+(5-n)H2O
250 160+18n
12.5g 8.9g
250:(160+18n)= 12.5g:8.9g
解得,n=1,
即此时所得晶体为CuSO4?H2O,
故45℃到110℃时反应的方程式为CuSO4?4H2O△CuSO4?H2O+3H2O。
(9) 根据题意,580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,根据质量守恒定律中的元素守恒可知,该金属氧化物应是氧化铜,故此反应的化学方程式为 2CuSO4 2CuO+2SO2↑+O2↑。
2CuO+2SO2↑+O2↑。
考点:物质的相互转化和制备,化学实验方案设计与评价,有关元素化合价的计算,书写化学方程式,根据化学反应方程式的计算
点评:本题难度较大,考查了多方面的知识,并侧重考查了学生运用所学化学知识综合分析和解决实际问题的能力,关于根据化学反应方程式的计算,解题的关键是要抓住“加热过程中,硫酸铜晶体会分步失去结晶水”这句话,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可。


科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

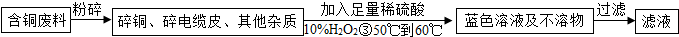
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2012届江苏省镇江市九年级5月中考模拟考试化学试卷(带解析) 题型:探究题
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4·XH2O)。
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
(2)CuSO4·XH2O可溶于水,在加热时会生成CuSO4和H2O。
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是: 。
(2)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为 。
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
。
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 。
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为 色,最终变为黑色;
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为 ;
(3)根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程)
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式: 。
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为 。碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3·Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为 ,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是 (填一种有机物名称)。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省镇江市九年级5月中考模拟考试化学试卷(解析版) 题型:探究题
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4·XH2O)。
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解。
(2)CuSO4·XH2O可溶于水,在加热时会生成CuSO4和H2O。
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:

方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:

(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是: 。
(2)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为 。
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
。
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 。
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。

(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为 色,最终变为黑色;
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为 ;
(3)根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程)
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式: 。
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为 。碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3·Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为 ,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是 (填一种有机物名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com