
下图是水分解反应的微观模拟图,请从微观角度回答下列问题:

(1)在此变化中发生改变的是_______,没有发生改变的是_______
(2)由此推出此变化的实质是_______________
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:初中化学 来源: 题型:阅读理解
| 实验内容 | 可能观察到的现象 | 结论 |
| 取白色粉末装入试管中,加入少量的水振荡后静置,取试管中的上层清液,滴加1~2无色酚酞试液 | 白色粉末中有 Ca(OH)2 | |
| 取上述试管中的残留的固体,加入稀盐酸 | 有气泡产生 | 白色粉末中有 CaCO3 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
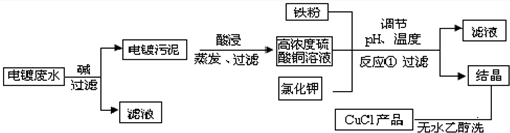
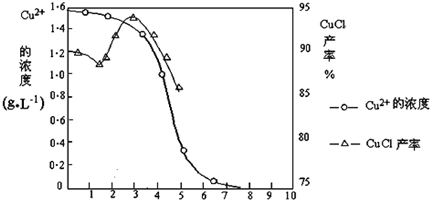
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
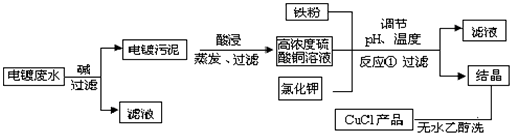
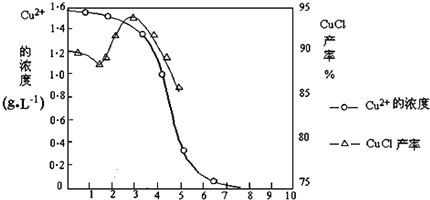
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
科目:初中化学 来源:0113 期中题 题型:实验题
| 下图是实验室制取气体的一些装置,据图回答有关问题。(以下所选装置均填装置标号) | ||
 | ||
| (1)写出序号为①②③的仪器名称:① ;② ;③ 。 (2)写出你知道的化学实验中可选用装置C制取气体的文字表达式 ; ①该装置中试管口要略向下倾斜目的是 ; ②收集所得气体可选用的一种装置是 。 ③如何检验收集的气体是氧气? 。 (3) 某学校化学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤: ①取5只250mL集气瓶,分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5; ②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去; ③将带火星的木条依次插入1~5号瓶中,把观察到现象和计算数据,填入下表。 | ||
 | ||
| 试回答下列问题: ①实验室中采用分解过氧化氢(H2O2)的方法制取氧气,可采用的发生装置是 (填标号) ,理由是 。其反应的文字表达式是 ,该反应所属的基本反应类型是 。 ②根据以上实验事实,下列说法中正确的是 (填写相应的标号)。 A.只有在纯氧中才能使带火星的木条复燃 B.集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃 C.只要有氧气存在就可使带火星的木条复燃 ③上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。请你再举一例,将实验内容和实验现象填写在下表中: | ||
 | ||
|
查看答案和解析>>
科目:初中化学 来源:2011年江苏省扬州中学教育集团树人学校中考化学模拟试卷(6月份)(解析版) 题型:解答题
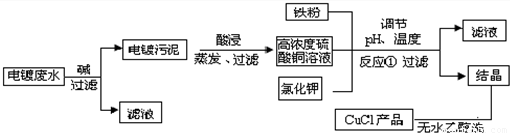
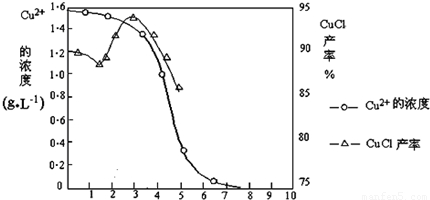
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com