
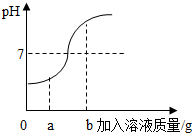
 小华同学在用稀硫酸和氢氧化钠溶液进行中和反应实验时,测得反应过程中溶液的酸碱度变化如图所示.
小华同学在用稀硫酸和氢氧化钠溶液进行中和反应实验时,测得反应过程中溶液的酸碱度变化如图所示.分析 (1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析确定操作的过程;
(2)根据此时溶液的酸碱度来分析;
(3)此时溶液显碱性,说明加入的氢氧化钠已经过量;
(4)根据稀硫酸与氢氧化钠反应生成硫酸钠和水反应的化学方程式进行计算.
解答 解:(1)由图象可知,pH值是开始时小于7逐渐的增大到7然后大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH升高,说明是把氢氧化钠溶液滴加到稀硫酸中;故填:氢氧化钠溶液;
(2)当加入的溶液质量为a克时,溶液的pH小于7,溶液显酸性,也就是稀硫酸有剩余,此时加入碳酸钠,会生成二氧化碳气体,故填:有气泡产生;
(3)当加入溶液的质量为bg时,溶液的pH大于7,溶液显碱性,说明氢氧化钠溶液过量,此时所得溶液中的溶质为反应生成的硫酸钠和过量的氢氧化钠;
故填:Na2SO4、NaOH;
(4)解:设需要4%的氢氧化钠溶液的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x×4% 100g×9.8%
$\frac{80}{98}=\frac{x×4%}{100g×9.8%}$
x=200g
答:需要用4%的氢氧化钠溶液的质量为200g.
点评 本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 目前,我国火力发电量占全国总发电量的80%以上.请回答问题:
目前,我国火力发电量占全国总发电量的80%以上.请回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洗涤剂去油污是乳化作用 | |
| B. | 金刚石、石墨物理性质不同是因为碳原子排列方式不同 | |
| C. | 羊毛、棉纤维和腈纶可通过灼烧方法区别 | |
| D. | 淀粉可用加碘食盐检测 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
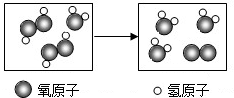
| A. | 反应前后分子个数不变 | |
| B. | 反应后的生成物都是氧化物 | |
| C. | 该反应是分解反应 | |
| D. | 反应的化学方程式为2H2O2+H2O═3H2O+O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com