
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],碱式碳酸铜受热易分解生成CuO、H2O和CO2 。据上述资料可推知,碱式碳酸铜由 ▲ 种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是 ▲ 。产生该气体的化学反应方程式为 ▲ 。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有 ▲ 、 ▲ 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ▲ ,② ▲ ,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一 段时间后,溶液颜色变浅。发生反应的化学方程式为 ▲ 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 ▲ 。
段时间后,溶液颜色变浅。发生反应的化学方程式为 ▲ 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 ▲ 。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
【答案】[查阅资料]②4 [实验探究](1)H2 Zn+2HCl====ZnCl2+H2↑(2)CuCl2 HCl(答案可互换)
①有气泡产生 ②有红色物质析出(溶液颜色变浅)(答案可互换)
(3)Zn+FeCl2====ZnCl2+ Fe Cu、Fe、Zn(或Cu<Fe<Zn) (4)80%
Fe Cu、Fe、Zn(或Cu<Fe<Zn) (4)80%
【解析】
试题分析:碱式碳酸铜受热易分解生成CuO、H2O和CO2,依据质量守恒定律化学反应前后元素的种类不变可知,碱式碳酸铜由C、H、O、Cu 四种元素组成;
(1)由于生满铜绿的“金戒指”材质为铜锌合金,锌能与盐酸反应生成氢气:Zn+2HCl====ZnCl2+H2↑,故还可能含有的气体是氢气;
(2)溶液变为蓝色,说明溶液中含有铜离子,即含有氯化铜;加入的是过量稀盐酸,那么还含有盐酸;铁能和氯化铜溶液发生置换反应生成铜和氯化亚铁,还能和盐酸反应生成氢气,故现象为有红色物质析出、有气泡产生;
(3)FeCl2溶液中加入锌粒,由于锌比铁的金属性更强,故能把铁置换出来:Zn+FeCl2====ZnCl2+Fe ,结合铁能把铜置换可知它们的活动性顺序是:Cu<Fe<Zn ;
(4)CuO中Cu%=64/(64+16)×100%=80%
3.8gCuO中m(Cu)=3.8g×80%=3.04g
据Cu元素守恒知:3.8g“金戒指”中m(Cu)=3.04g
“金戒指”中Cu%=3.04g/3.8g×100%=80%
考点:金属活动性、常见反应、质量守恒定律


科目:初中化学 来源: 题型:
电解水实验中,为了增加水的导电性,可在水中加入一定量的硫酸钠。
(1)某次实验中,将20克9%的硫酸钠溶液倒入盛有160克水的烧杯中,混合均匀后,所得溶液的溶质质量分数为 ;
(2)将上述所得溶液全部倒入电解水装置,当通电反应到所剩溶液中的含水量为98%
时,可制得多 少克氢气?(要求利用化学方程式计算)
少克氢气?(要求利用化学方程式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
化学小组在老师的指导下,完成了一个兴趣实验。向包有Na2O2的脱脂棉中吹气,发现脱脂棉剧烈燃烧起来。于是他们决定探究脱脂棉燃烧的原因。请你参与他们的探究。
【提出问题】脱脂棉为什么会燃烧?
【查阅资料】
1. Na2O2是一种淡黄色固体,常温下能与CO2、H2O、HCl气体等物质发生反应,不能与N2发生反应。
2. 人呼出的气体的主要成分及含量:N2:74%;O2:16%;水蒸气:6%;CO2:4%
3. CO2既不与NaHCO3反应,也不溶于饱和的NaHCO3溶液。
【猜想与假设】
1. 可能是CO2与Na2O2反应产 生了O2,释放出热量。
生了O2,释放出热量。
2. 可能是H2O与Na2O2反应产生了O2,释放出热量。
3. 可能是_______与Na2O2反应产生了O2, 释放出热量。
释放出热量。
【实验验证】
实验I:验证CO2与Na2O2反应产生了O2,释放出热量。
甲小组同学用图1所示装置(部分夹持装置略去)制取并收集了一瓶CO2气体,将包有Na2O2的脱 脂棉放在燃烧匙中,伸入集气瓶,观察到脱脂棉剧烈燃烧。得出结论,猜想1成立。乙小组同学认为上述实验不足以证明CO2与Na2O2反应产生了O2,理由是__________。
脂棉放在燃烧匙中,伸入集气瓶,观察到脱脂棉剧烈燃烧。得出结论,猜想1成立。乙小组同学认为上述实验不足以证明CO2与Na2O2反应产生了O2,理由是__________。
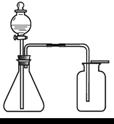
图 1
同学们经过讨论,对上述实验方案进行了改进,用图2所示的装置(部分夹持装置略去)进行实验验证猜想1成立。打开止水夹K,鼓入纯净、干燥的氮气一段时间后,关闭止水夹K。注入稀盐酸,观察到脱脂棉剧烈燃烧。
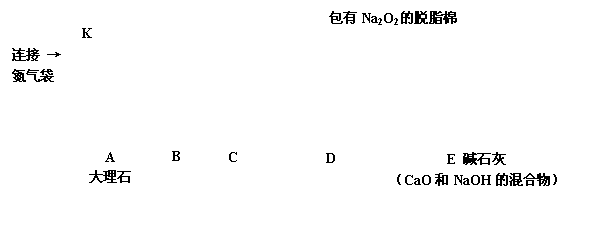 |
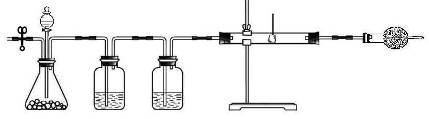
图 2
【解释与结论】
1.装置A中发生反应的化学方程式为________________。
2.装置B的作用是__________________。
3.装置C中盛放的药品是___________,作用是__________________。
实验II:验证H2O与Na2O2反应产生了O2,释放出热量。
请你设计一个实验方案,验证H2O与Na2O2反应产生了O2,释放出热量(写出实验步骤、现象及结论)___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式__________________________________________。
(2)小兵用右图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从_______(填e或f或g)管通入。
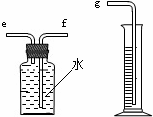
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是_______________________________________________________。
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因_______________________________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证_______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列事实的结论或解释中不正确的是
A.水烧开后易把壶盖冲起——温度升 高分子间隔变大
高分子间隔变大
B.墙内开花墙外香——分子在不断运动
C.盐酸、硫酸都具有酸的通性——它们在水溶液中都能电离出H+
D.铝及其合金是电气、工业、家庭广泛使用的材料——铝比铁更活泼
查看答案和解析>>
科目:初中化学 来源: 题型:
下列实验方案或措施合理的是( )
A.除去CaO中混有的CaCO3,先加足量水,然后过滤
B.除去MnO2粉末中混有的KCl,先加足量水溶解、过滤、洗涤、干燥
C.用无色酚酞试剂检测氢氧化钠是否变质
D.除去硝酸钠中少量硝酸铜,加足量铁粉,过滤、蒸发结晶
查看答案和解析>>
科目:初中化学 来源: 题型:
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示:
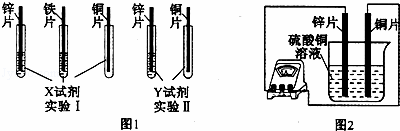
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com