
| 实验编号 | 反应物 | 酸的质量分数% | 反应的温度℃ | 金属丝消失的时间s |
| ① | 铝丝和稀盐酸 | 5 | 20 | 450 |
| ② | 铝丝和稀盐酸 | 10 | 20 | 240 |
| ③ | 铝丝和稀盐酸 | 10 | 30 | 65 |
| ④ | 铁丝和稀盐酸 | 10 | 30 | 125 |
| ⑤ | 铝丝和稀硫酸 | 10 | 30 | 超过1000 |
分析 根据金属在空气中其表面会生成一层氧化膜,氧化膜会先与酸反应生成盐和水,几乎不能生成氢气,反应物浓度、反应温度、有无催化剂、反应物接触面积等会影响反应速率,可以在其它条件相同的情况下探究一种条件对反应速率的影响.在这5次实验中通过反应温度相同盐酸浓度不同的实验比较可得出:酸的质量分数与反应速率有关;通过酸的质量分数相同而反应温度不同的实验比较可得出:在其他条件相同的情况下,金属和酸反应的快慢与反应的温度有关,反应的温度越高,反应越快;通过其它条件相同而盐酸和硫酸反应物各类不同的实验比较好可得出:硫酸根离子对金属和酸反应有阻碍作用.
解答 解:
(1)金属在空气中其表面会生成一层氧化膜,氧化膜会阻止金属与药品接触,要先除去氧化膜,所以实验前,用砂纸打磨金属片的目的是除去金属表面的氧化膜;故答案为:除去金属表面的氧化膜;
(2)在这5次实验中只有③和④中只有金属种类发生了变化而其它条件相同.故答案为:③和④;
通过实验②和③的比较可看出:在其他条件相同的情况下,金属和酸反应的快慢与反应的温度有关,反应的温度越高,反应越快,20℃时金属消失时间为240s 30℃时金属消失时间为65s,温度从20℃到25℃温度升高了反应速率加快,故答案为:65s-240s
(3)质量相同的金属丝和足量稀酸反应,金属丝消失的时间来反应金属和酸反应的快慢.故答案为:质量相同的金属丝和足量稀酸反应,金属丝消失的时间;
(4)对比试验①和②可知,其它条件相同只是酸的质量分数发生了变化,金属消失的时间发生了变化即反应速度发生了变化因此反应速率与酸的质量分数有关;在这5次实验中只有③和④中只有金属种类发生了变化而其它条件相同.故答案为:金属和酸反应的快慢与酸的质量分数有关.
点评 本题考查了反应温度、反应物浓度,反应物种类等因素对反应速率的影响,通过对实验数据的分析比较得出实验结论,重点培养学生分析比较数据的能力和实验探究能力.


科目:初中化学 来源: 题型:选择题
| A. | 开始由白色沉淀,没有出现气泡 | |
| B. | 开始看到有大量气泡冒出,之后气泡逐渐减少并开始出现沉淀 | |
| C. | 开始没有出现气泡,一段时间后有气泡,没有出现沉淀 | |
| D. | 开始冒气泡,后出现白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 生石灰 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | CaO | Ca(OH)2 | Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 与足量稀盐酸充分反应,用排水法收集到 VmL气体 | |
| B. | 与足量稀盐酸充分反应,称量反应后的溶液,质量为 m1g | |
| C. | 与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体 | |
| D. | 与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加 m3g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
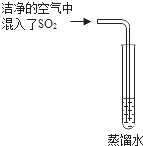 雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com