请根据碳铵(NH4HCO3)的化学式进行计算:
(1)计算碳铵的相对分子质量.
(2)计算该物质中氮元素的质量分数.
(3)200克碳铵中含氮元素质量多少.
(4)多少克尿素CO(NH2)2与500克碳铵NH4HCO3所含氮元素质量相当.
解:(1)根据碳铵(NH
4HCO
3)的化学式可知,碳铵的相对分子质量=14+5+12+16×3=79;
(2)该物质中氮元素的质量分数=
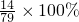
≈17.7%;
(3)200g×17.7%=35.4g;
(4)尿素CO(NH
2)
2中氮元素的质量分数=
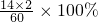
≈46.7%,
500g×17.7%÷46.7%=189.5g.
答:(1)碳铵的相对分子质量为79;
(2)该物质中氮元素的质量分数为17.7%;
(3)200克碳铵中含氮元素质量为35.4g;
(4)189.5g克尿素CO(NH
2)
2与500克碳铵NH
4HCO
3所含氮元素质量相当.
分析:(1)根据碳铵(NH
4HCO
3)的化学式,碳铵的相对分子质量=(氮的相对原子质量×氮原子的个数)+(氢的相对原子质量×氢原子的个数)+(碳的相对原子质量×碳原子的个数)+(氧的相对原子质量×氧原子的个数);
(2)该物质中氮元素的质量分数=

;
(3)200克碳铵中含氮元素质量=200g×碳铵中含氮元素的质量分数;
(4)先计算出尿素CO(NH
2)
2中氮元素的质量分数,再根据氮元素的质量÷尿素CO(NH
2)
2中氮元素的质量分数计算即可.
点评:本题主要考查学生运用化学式和元素的质量分数公式计算的能力.

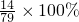 ≈17.7%;
≈17.7%;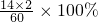 ≈46.7%,
≈46.7%, ;
;
