金属镁将成为二十一世纪大有前途的绿色金属材料.
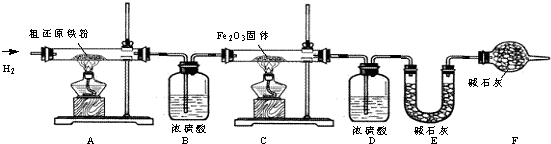
海水中的MgCl2熟石灰过滤Mg(OH)2蒸发、浓缩、结晶MgCl2?6H2O脱水MgCl2通电Mg
(1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
①在实验室进行过滤操作时需要用到玻璃棒,其作用是
引流
引流
.
②电解熔融氯化镁的过程中,
电
电
能转化为
化学
化学
能.
③写出氯化镁与熟石灰反应的化学方程式
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
.
(2)①取两块大小相同的干冰,在干冰中央挖一个小穴,撒入一些镁粉,用红热的铁棒把镁点燃,将另一块干冰盖上,你会看到镁粉在干冰内继续燃烧,发出耀眼的白光,像冰灯一样.已知该反应的生成物是氧化镁和碳.此反应的方程式是
,此反应属于
置换
置换
反应(判断基本反应类型).该实验证明干冰具有
在点燃条件下能与镁反应
在点燃条件下能与镁反应
的性质(答一条即可);为验证上述反应所得固体中无剩余镁,可向该固体中加入试剂得名称为
稀盐酸
稀盐酸
,反应的现象是
有气泡产生
有气泡产生
.②金属镁在高温下与氮气反应生成氮化镁,氮化镁中氮元素的化合价-3.据此写出氮化镁的化学式
Mg3N2
Mg3N2
.
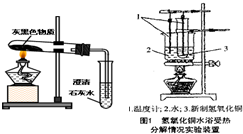
(3)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属.但拿出的镁条总是有一层灰黑色,这层灰黑色是什么物质呢?
猜想:小明认为可能是MgO;小赵认为可能是Mg
2(OH)
2CO
3;小花认为可能是Mg(OH)
2.小赵认为小明的猜想是错误的,其理由是
氧化镁通常为白色固体
氧化镁通常为白色固体
.
实验探究:小赵按右图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体.实验分析:实验后,小赵认为小花的猜测也是错误的,其理由
石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素
石灰水变浑浊的现象可说明此变化过程中有二氧化碳生成,而氢氧化镁中根本不含碳元素
.
查阅资料得出结论:Mg(OH)
2和Mg
2(OH)
2CO
3都可以加热分解,产物均为氧化物,请写出Mg
2(OH)
2CO
3加热分解的化学方程式
Mg
2(OH)
2C0
32MgO+H
2O+CO
2↑;
Mg
2(OH)
2C0
32MgO+H
2O+CO
2↑;
_
删除本空
删除本空
..
(4)镁铝合金广泛用于火箭、导弹和飞机制造业等.某兴趣小组为探究镁铝合金的组成,取16g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中(只有铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,镁与氢氧化钠溶液不反应),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
| 所加氢氧化钠溶液的次数 |
第一次 |
第二次 |
第三次 |
| 剩余固体的质量/g |
10.6 |
5.2 |
4.0 |
从以上数据可知,该合金中,镁元素与铝元素的质量比为
1:3
1:3
所用氢氧化钠溶液的溶质质量分数为
40%
40%
.

 3CO2+4Fe,下列说法中正确的是
3CO2+4Fe,下列说法中正确的是

 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.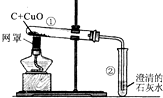 碳与碳的化合物在工农业生产及日常生活中有广泛的用途.
碳与碳的化合物在工农业生产及日常生活中有广泛的用途.