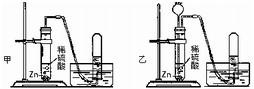
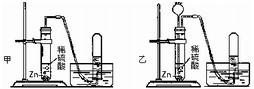
解:(1)等质量的镁、铝完全反应,可根据计算得知,产生氢气的质量铝大于镁,所以选择金属时应选择铝;而稀盐酸与稀硫酸相比,10%的稀盐酸比10%的稀硫酸所含H
+浓度要大,即等量的稀盐酸可产生更多的氢气;综上所述,要使小车行程最远,应选择②⑤,并使药品恰好完全反应,让效率达最大化;根据反应的化学方程式,可计算铝与稀盐酸恰好完全反应的质量比为:
(27×2):
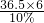
=9:365;
故答:②⑤;恰好完全反应(或铝粉与稀盐酸l的质量比为9:365);2Al+6HCl=2AlCl
3+3H
2↑;
(2)要使小车比(1)的运动速度快,选择比铝活泼的金属镁进行反应,同时用到酸的氢离子的浓度,放出氢气速度更快;所以应该是选①④.
故答:①④;镁比铝活泼,产生氢气速度快;
(3)不发生反应而释放出气体,可考虑固体物质的升华气化如干冰等或极易挥发的物质如汽水等;
故答:干冰(或汽水);
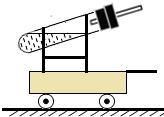
(4)在现有条件不变的情况下,使小车跑得更远,就应使小车获得更大的推力.可把导管弯曲成与小车运动方向水平,使力集中于推动小车;或使氢气燃烧面发生爆炸,使气体体积迅速膨胀而获得更大的推动力.
故答:使小车获得更大的推力;
改进的方法:将橡皮塞上导管的出口换成与道路水平;理由:这样使小车受到的推进力最大
改进的方法:点燃产生的氢气;理由:氢气燃烧时会产生反作用力.
分析:(1)小车在同一条水平道路上行程最远,小车是在气体放出时产生的推力作用下前进,行程远近与产生气体多少成正比,产生气体最多的小车行程最远;
(2)小车运动的快慢决定于放出氢气的速度,产生氢气速度越快小车的运动速度越快,因此要使小车的运动速度比(1)中所选试剂时快,就应选择金属活动性(1)中金属更活动的金属;
(3)小车的运动是由于试管内气体冲出时产生的推力,因此,要使小车运动,只要能使试管内释放出气体即可;
(4)不改变提供的试剂、不改变试剂总质量及小车、道路的条件下,从理论上讲,使小车跑的更远就应使小车获得更大的推力.改进的方向就是使推力最大化.
点评:等量的Al、Mg、Fe、Zn金属与足量酸完全反应,放出氢气的量由多到少的顺序为:Al>Mg>Fe>Zn.

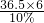 =9:365;
=9:365;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案