
分析 (1)根据氢氧化钠与盐酸反应的方程式结合氯化氢的质量计算氢氧化钠的质量,进一步计算该NaOH溶液的溶质质量分数.
(2)根据(1)信息可知“标定该氢氧化钠溶液20.00mL,需要浓度为0.365%的稀盐酸5.00mL.”进行分析;
解答 解:(1)稀盐酸的质量为5.00mL×1.0g•mL-1=5.00g,氢氧化钠溶液的质量为20.00mL×1.0g•mL-1=20.00g,
设该氢氧化钠溶液中氢氧化钠的质量为x
NaOH+HCl═NaCl+H2O,
40 36.5
x 5.00g×0.365%
$\frac{40}{x}=\frac{36.5}{5.00g×0.365%}$
x=0.02g
该NaOH溶液的溶质质量分数$\frac{0.02g}{20.00g}$×100%=0.1%
答:该NaOH溶液的溶质质量分数0.1%
(2)可知“标定该氢氧化钠溶液20.00mL,需要浓度为0.365%的稀盐酸5.00mL.”所以再向瓶内缓缓倒入10mL0.365%的稀盐酸,盐酸过量,溶液显酸性,酚酞为无色,当取3mL混合液时,其中剩余的氯化氢的质量为5g×0.365%×$\frac{3mL}{30mL}$=设2滴氢氧化钠溶液能中和的氯化氢质量为y,
NaOH+HCl═NaCl+H2O,
40 36.5
0.05g×2×0.1% y
$\frac{40}{0.05g×2×0.1%}=\frac{36.5}{y}$
y=9.125×10-5g<1.825×10-3g
所以盐酸有剩余,溶液为无色.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

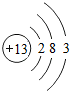 ,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.
,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.查看答案和解析>>
科目:初中化学 来源: 题型:推断题


查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A~H是初中化学常见的物质,其中A为白色固体,E为黑色固体(一种金属氧化物),H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.(1)写出下列物质的化学式:ACaCO3,GCuSO4,HCu(OH)2.
A~H是初中化学常见的物质,其中A为白色固体,E为黑色固体(一种金属氧化物),H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.(1)写出下列物质的化学式:ACaCO3,GCuSO4,HCu(OH)2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com