
【题目】为了测定液化气中丙烷(![]() )在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为5.6 B.X可能是该反应的催化剂
C.X可能含有氢元素 D.X只含碳元素
【答案】A
【解析】
试题分析:A.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则可求出a的质量=4.4+12.8-7.2-4.4=5.6,故A正确;
B.X在反应前质量为0,而反应后质量为5.6克,则不符合催化剂的特点“只改变反应速率,而本身的质量和化学性质都不变”,故X一定不是该反应的催化剂;
C.根据质量守恒定律,反应前后元素的质量不变,可求4.4克丙烷(![]() )中氢元素的质量=4.4g×
)中氢元素的质量=4.4g×![]() =0.8g,再求水中氢元素的质量=7.2g×
=0.8g,再求水中氢元素的质量=7.2g×![]() =0.8g,故X中不含有氢元素;
=0.8g,故X中不含有氢元素;
D、根据化学方程式计算,可求:4.4克丙烷(![]() )中碳元素的质量=4.4g-0.8g=3.6g,二氧化碳中碳元素的质量=4.4g×
)中碳元素的质量=4.4g-0.8g=3.6g,二氧化碳中碳元素的质量=4.4g×![]() =1.2g,a中含有的碳元素是3.6g-1.2g=2.4g,而a的质量的5.6g,则a中一定会含有氧元素;
=1.2g,a中含有的碳元素是3.6g-1.2g=2.4g,而a的质量的5.6g,则a中一定会含有氧元素;


科目:初中化学 来源: 题型:
【题目】某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式是________________。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:①溶质为________;②溶质为____________________ 。
(3)请你设计两种实验方案来验证以上猜想。
方案 | 实验操作 | 实验现象 | 结 论 |
方案一 | __________ | __________ | 猜想①成立 |
方案二 | ___________ | _________ | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据所学的知识并结合下列仪器,回答有关问题:

(1)写出仪器的名称B ,C 。
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用A、D、E、F,I外,还需增加的仪器是 ,反应的化学方程式为 。
(3)实验室用 为原料(填两种原料名称)来制取二氧化碳,组装一套发生装置所需的仪器 (填字母)。
(4)实验室还用Zn和稀H2SO4来制取氢气,反应的化学方程式为 。
(5)某同学制作的微型实验装置(夹持仪器略)。甲酸与热的浓硫酸反应的方程式为:![]()
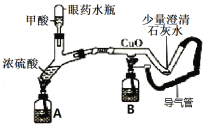
①则X是 (填化学式);
②实验开始时先要点燃A处酒精灯一段时间后,再点燃B处酒精的目的是 。
③此实验装置的主要优点是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将铁粉和铜粉混合物7.0g,加入到盛有60.0 g稀盐酸的烧杯中,恰好完全反应。此时烧杯内各物质的总质量为66.8 g。试计算:
(1)原混合物中铁粉的质量分数。(精确到0.1%)
(2)反应后所得溶液中溶质的质量分数。(精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于空气的说法中,错误的是( )
A. 按质量计算,空气中约含氮气78%,氧气21%,其他气体和杂质约占1%
B. 少量有害气体进入空气中,依靠大自然的自净能力,空气仍能保持洁净
C. 空气是一种十分重要的天然资源
D. 空气中的稀有气体一般不跟其他物质反应,曾被称为“惰性气体”
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳还原氧化铜的实验装置。某化学小组对该实验及产物的探究如下:
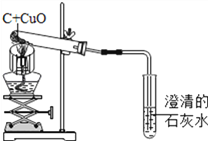
【分析】
(1)写出该反应的化学方程式_______________________。
(2)酒精灯加网罩的目的是_________________________。
(3)刚开始加热时,澄清石灰水中有气泡冒出,但澄清石灰水不变浑独,原因是_______________。
(4)实验结束应先_________。(选填答案序号)
A.撤离酒精灯 B.将导管移出石灰水. C.拨掉橡胶塞
【探究一】检验产物成分
【提出问题】:实验产物是暗红色固体,很难观察到紫红色固体,暗红色固体是什么?
【查阅资料】:氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4 =CuSO4 +Cu + H2O。
【猜想与假设】:暗红色固体除铜外还可能含有Cu2O
【设计实验】
(5)操作:取少量暗红色固体,加入稀硫酸,观察到现象:___________、_____________。结论:暗红色固体含有Cu2O。
【探究二】测定产物中Cu2O的含量
(6)为测定红色固体中氧化亚铜的质量分数,小组同学设计了如下两种方案:
甲方案:甲同学称取10g红色固体加人到足量稀硫酸中使其充分反应后,过滤_______(填操作名称)、干燥、称量剩余红色固体的质量为8 g,则红色固体中氧化亚铜的质量分数为__________。
乙方案:实验原理:Cu2O +H2![]() 2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。
2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。
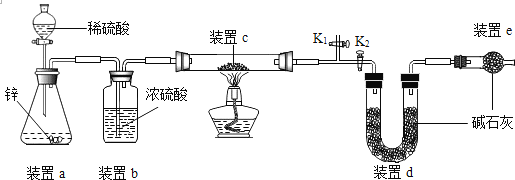
(7)装置a中用稀硫酸而不用稀盐酸,原因是_______________;
(8)若不加装置c,实验结果会偏_______(“大”或“小”),原因是_______________;
(9)点燃酒精灯前涉及的部分操作如下,正确的顺序是_____________;
①打开K2,关闭K1 ②检查装置的气密性 ③连接仪器 ④关闭K2,打开K1,通氢气一段时间
【拓展反思]】:
(10)还可通过测定反应前后装置________(填“a”、“b”、“c”)的质量达到测定产物中Cu2O的含量目的。
(11)乙方案第(9)的④中“通氢气一段时间”的目的是排出装置内的空气,否则可能带来哪些影响?__________、_____________(答出两点)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)某市热电厂使用的燃料是含硫较多的煤.该厂附近一所中学的同学经常闻到空气有异味,且空气能见度差.学习化学后,同学们意识到这有可能是该厂排出的废气超标造成的,于是在老师的指导下做了探究实验,请你填写下列空白,
【提出问题】该厂附近所降雨水是否是酸雨?空气里SO2是否超标呢?
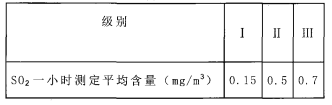
【查阅资料】I.我国关于SO2在风景区、居民区、工厂区的空气质量最高标准分别见下表:
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应).
【设计实验1】第一组同学取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:

所降雨水 (填“是”或“不是”)酸雨。在测定时间内酸雨pH减小的原因可能是__
【设计实验2】第二小组同学设计以下步骤来测定空气中SO2的含量.
(1)用2L的空可乐瓶采集工厂附近的空气样品,采样的具体操作是:
(2)向取回的装有空气样品的可乐瓶中倒入NaOH溶液,盖紧瓶塞后充分振荡,仿照CO2与NaOH溶液的反应,写出SO2与NaOH溶液反应的化学方程式:
(3)加入一定量氧化剂H2O2,使其中Na2SO3完全转化为Na2SO4.向可乐瓶中加入过量的BaCl2溶液.Na2SO4和BaCl2反应的化学方程式为: ____
(4)经过过滤、洗涤、烘干,称量固体质量为1.165mg.
计算:1.165mg硫酸钡中硫元素的质量为 mg.由质量守恒定律可知,2L空气样品中SO2的质量为 mg.
由空气质量标准可得出结论:该厂排放的SO2严重超标.。
【发现新问题】考虑到空气中的各种气体成分,第一组认为第二组同学的SO2的含量偏大,其依据是 ;你提出的实验改进方案是
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com