


分析 探究活动一:
根据碳酸钠与盐酸反应生成二氧化碳气体,碳酸钠与氢氧化钙不能共存分析解答;氢氧化钠显碱性能使酚酞变红色;
探究活动二:过量稀硝酸可以除去溶液中的碳酸钠和氢氧化钠;加入的X应是硝酸钡是为了检验硫酸钠的存在与否;硝酸银是为检验氯化钠的存在与否;
解答 解:探究活动一
(1)向第一份溶液中加入稀盐酸溶液后,观察现象有气泡产生,证明:原溶液中一定含有碳酸钠. 碳酸钠与氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠,不能共存;所以原溶液中含有碳酸钠,就一定不含有氢氧化钙;
(2)原溶液中一定含有氢氧化钠,应向第二份溶液中加入足量氯化钙溶液与碳酸钠反应后过滤,溶液仍为红色,说明一定含有氢氧化钠;
探究活动二:
(3)过量稀硝酸可以除去溶液中的碳酸钠和氢氧化钠;加入的X应是硝酸钡,加入后有沉淀出现说明硫酸钠存在;硝酸钡和硫酸钠溶液相互交换成分生成硫酸钡沉淀和硝酸钠,反应的化学方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
(4)加入硝酸银没有出现沉淀说明原溶液中一定没有氯化钠;实验Ⅱ、Ⅲ得出的结论是原溶液有Na2SO4、无NaCl;
(5)故溶液C中含有的溶质加入的过量的硝酸、碳酸钠和氢氧化钠与硝酸反应生成的硝酸钠、以及加入的硝酸钡和硝酸银;
答案:
(1)有气泡产生; Ca(OH)2;
(2)有白色沉淀生成,溶液仍为红色;
(3)Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
(4)原溶液有Na2SO4、无NaCl
(5)HNO3、NaNO3、Ba(NO3)2、AgNO3
点评 解答本题要掌握各种物质的性质和过程中的实验现象等方面的知识,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:解答题
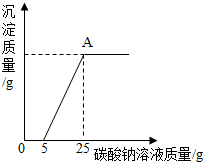 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 25g | 50g | m(80<m<150) | 150g |
| 剩余固体的质量 | 7.5g | 5g | 2g | 2g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积、同浓度的稀硫酸. | 盛有Mn、Fe的试管内都有气泡产生,锰片的反应比铁片的反应剧烈,盛有Cu的试管中没有产生气泡. | 猜想三错误. |
| ②向盛有硫酸亚铁溶液的试管中加入金属Mn. | 有黑色固体析出. | 猜想一正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
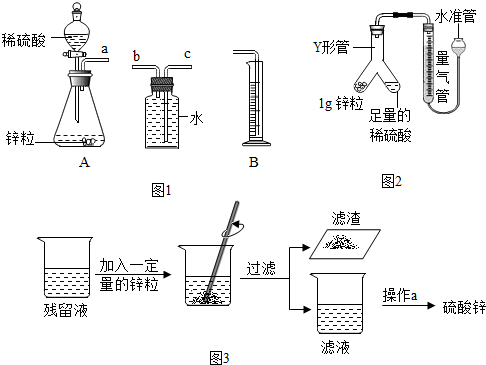
| 实验编号 | 硫酸的浓度 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3min) |
| ① | 20% | 大颗粒 | 31.7 |
| ② | 20% | 小颗粒 | 50.9 |
| ③ | 30% | 大颗粒 | 61.7 |
| ④ | 30% | 小颗粒 | 79.9 |
| 时段 | 第1min | 第2min | 第3min | 第4min | 第5min | 第6min |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
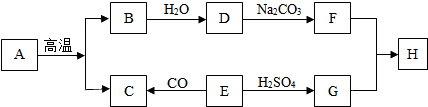
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com