
| A. | 用紫色石蕊试液可以区分氢氧化钠溶液和澄清石灰水 | |
| B. | 用观察颜色的方法可鉴别磷矿粉和硫酸铵 | |
| C. | 用适量BaCl2溶液可除去KNO3溶液中混有的K2SO4 | |
| D. | 配制一定溶质质量分数的稀硫酸时,应将水倒入浓硫酸中稀释 |
分析 A、鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别.
B、根据磷矿粉是灰白色的,硫酸铵是白色的晶体,进行分析判断.
C、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
D、根据浓硫酸的稀释方法进行分析判断.
解答 解:A、氢氧化钠溶液和澄清石灰水均显碱性,均能使紫色石蕊溶液变红色,不能鉴别,故选项说法错误.
B、磷矿粉是灰白色的,硫酸铵是白色的晶体,可用观察颜色的方法可鉴别磷矿粉和硫酸铵,故选项说法正确.
C、适量BaCl2溶液能与K2SO4反应生成硫酸钡沉淀和氯化钾,能除去杂质但引入了新的杂质氯化钾,不符合除杂原则,故选项说法错误.
D、配制一定溶质质量分数的稀硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;故选项说法错误.
故选:B.
点评 本题难度不大,掌握物质的鉴别的原理与方法、抓住除杂质的必需条件、浓硫酸的稀释方法是正确解答本题的关键.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:初中化学 来源: 题型:解答题
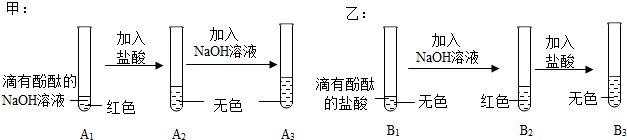
| 探究环节 | 甲同学的探究 | 乙同学的探究 |
| 提出问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
| 做出猜想 | 实验过程中,酚酞变质了? | 猜想一:NaCl 猜想二:NaCl HCl |
| 实验验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想不成立(填“成立”或“不成立”) (2)你认为,在常温下A2溶液测出的pH 应<(填“>”、“=”或“<”)7 | 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变浅绿色,据此,你认为乙同学的猜想二(填“一”或“二”)成立 |
| 交流反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是NaOH+HCl=NaCl+H2O. (2)A3溶液未变红,你认为原因是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和. (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制. | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
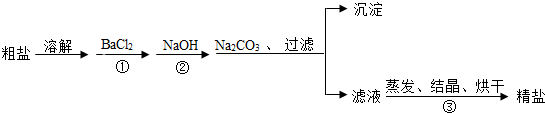
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 盐溶液 | NaCl | Na2CO3 | CaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样品溶于水配成溶液,向溶液中滴加CaCl2溶液至过量,充分反应后,静置. | 产生白色沉淀 | 说明久置固体中一定含有Na2CO3(填化学式,下同). |
| ②用玻璃棒蘸取少量①的上层清液滴在pH试纸上,与标准比色卡对照. | pH=11 | 说明久置固体中还一定含有NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
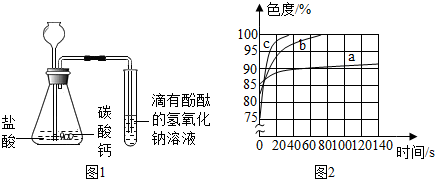
| 实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
| ①将NaOH溶液加热煮沸 | ①除去溶液中的氧气 | 溶液变红,过一会儿红色消失 | 甲同学猜想不正确(填“正确”或不正确”) |
| ②向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 | ②隔绝氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
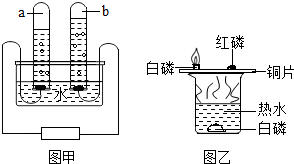 请回答以下问题.
请回答以下问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
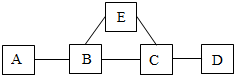 如图所示,图中的A、B、C、D、E分别为稀盐酸、石灰水、氧化铜、二氧化碳、苏打溶液中的一种.图中的短线相连的物质均能相互发生化学反应,已知E、C反应有气泡出现.于是有:
如图所示,图中的A、B、C、D、E分别为稀盐酸、石灰水、氧化铜、二氧化碳、苏打溶液中的一种.图中的短线相连的物质均能相互发生化学反应,已知E、C反应有气泡出现.于是有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com