
(7分)人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是_________________。
(2)根据下图的金属应用实例推断,金属具有的物理性质依次为_________________。



电线 金属丝 炊具
(3)某实验室的废液中含有大量的FeSO4、CuSO4,小刚同学欲从上述废液中回收Cu,并得到副产品FeSO4,设计实验流程如下图所示,回答问题:
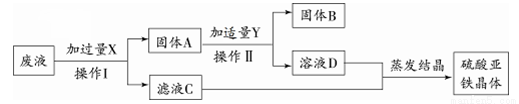
①操作Ⅰ的名称是_______________。
②固体A是_______________ 。
③废液与X发生反应的化学方程式为___________________。
(4)将一定量的锌加入到硫酸镁、硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生。滤渣中一定含有的物质是________;滤液中一定含有的溶质是___________。
(1)Al (2)导电性 延展性 导热性
(3)①过滤 ②Fe Cu ③ Fe+CuSO4==Cu+FeSO4
(4)铁、铜 硫酸镁、硫酸锌
【解析】
试题分析:(1)地壳中含量最高的金属元素是铝元素。
(2)电线主要利用了金属具有良好的导电性;金属丝主要利用金属具有良好的延展性;炊具主要利用了金属的导热性。
(3)本实验的目的是:从上述废液中回收Cu,并得到副产品FeSO4。流程图可知:固体B为Cu。滤液CD为硫酸亚铁溶液。进一步可推知:X为铁;固体A的成分为铁和铜的混合物。Y为稀硫酸。①操作I将物质分成了固体和滤液,所以应为过滤。②固体A是铁和铜。
③废液与X发生反应的化学方程式为Fe+CuSO4==Cu+FeSO4。
(4)将一定量的锌加入到硫酸镁、硫酸亚铁和硫酸铜的混合溶液中,充分反应。当“向滤渣中加入盐酸,有气泡产生”说明滤渣应含有活动性在氢之前的金属。因为涉及的四种金属的活动性顺序为:镁>锌>铁>铜。锌可先后与硫酸铜、硫酸铁反应生成铜和铁。滤渣中一定有铁和铜,可能有锌。则滤液中一定含有的物质为未参加反应的硫酸镁、反应生成的硫酸锌;可能含硫酸亚铁;一定不含硫酸铜。
考点:地壳中的元素、金属的性质、金属活动性顺序的应用


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源:2013-2014四川省乐山市沐川县初三二调考试化学试卷(解析版) 题型:选择题
2014年4月3日晚,一辆满载黄磷的货车在沐川新凡境内翻车,引起黄磷自燃。烟雾中的五氧化二磷颗粒极易与水蒸气结合而生成有毒的偏磷酸(HPO3)。下列说法错误的是
A. 路人为避免呼吸道刺激带口罩 B. 用水灭火
C. 白磷自燃属于氧化反应 D. 用河沙覆盖燃烧的白磷
查看答案和解析>>
科目:初中化学 来源:2013-2014北京市顺义区中考一模化学试卷(解析版) 题型:选择题
甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
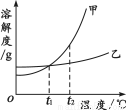
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大
C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D.t1℃时,甲和乙的饱和溶液各100 g,其溶质的质量一定相等
查看答案和解析>>
科目:初中化学 来源:2013-2014北京市门头沟区中考一模化学试卷(解析版) 题型:计算题
(3分)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。硅生产过程中的一个重要化学反应为SiO2 + 2C 高温 Si + 2CO↑。若生产5.6 g硅,理论上需要二氧化硅(SiO2)多少克?
查看答案和解析>>
科目:初中化学 来源:2013-2014北京市门头沟区中考一模化学试卷(解析版) 题型:选择题
下列实验方案中,能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 分离碳酸钠和氢氧化钠的混合物 | 加入过量氢氧化钙溶液,过滤 |
B | 除去氯化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
C | 检验二氧化碳气体中含有少量的一氧化碳 | 将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化 |
D | 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 | 各取少量溶液于试管中,分别滴加无色酚酞溶液,观察溶液颜色的变化 |
查看答案和解析>>
科目:初中化学 来源:2013-2014北京市通州区中考一模化学试卷(解析版) 题型:计算题
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
反应时间 | t1 | t2 | t3 | t4 | t5 |
烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源:2013-2014北京市西城区九年级毕业会考化学试卷(解析版) 题型:选择题
甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
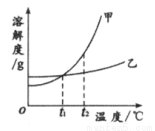
A. 甲的溶解度比乙的大
B. t1℃的甲、乙饱和溶液升温至t2℃仍为饱和溶液
C. 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D. 将甲、乙的饱和溶液从t2℃降到t1℃,所得溶液中溶质的质量分数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com