
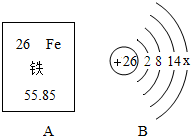
 2014��������֣ŷ�����ۼƿ���20�࣬�ۺ�Ӱ�����ӹ�����ŷ������λ�����ڴ�ͨ��ŷ���ô������ƽ����߹��Һ͵������÷�չ����Ҫ�����壮�ڽ���֣ŷ���е���Ҫ�����У����������˾�����ã�
2014��������֣ŷ�����ۼƿ���20�࣬�ۺ�Ӱ�����ӹ�����ŷ������λ�����ڴ�ͨ��ŷ���ô������ƽ����߹��Һ͵������÷�չ����Ҫ�����壮�ڽ���֣ŷ���е���Ҫ�����У����������˾�����ã����� ��1���ٸ���Ԫ�����ڱ��е���Ϣ���з�����
�ڸ���Ԫ�ؿ������õ��Ⱥ�˳��ͽ������˳���йؽ��з�����
��3�������������ԭ�����з�����
��4�����ݽ������˳���֪�����ֽ����Ļ��˳��Ϊ��þ������ͭ������������������������ͭ�Ļ����Һ�У�����һ���������ۣ�����������������Ӧ��������������������������ͭ��Ӧ��������������ͭ��������������þ��Ӧ���������еμ�ϡ���ᣬ�����ݲ�����˵��������һ��������������Ҳһ����������ͭ���з�����
��5�������������ᷴӦ��������������������Ȼ�������е����ݽ��з�����
��� �⣺��1���ٸ���Ԫ�����ڱ�ÿһ�����е���Ϣ��֪�������ԭ������Ϊ55.85��
��Ԫ�ؿ������õ��Ⱥ�˳��ͽ������˳���йأ���ѡ��B��
��3������Ʒ�ڳ�ʪ�Ŀ������������⣬ʵ���������Ϳ����е�������ˮ������ѧ��Ӧ��
��4�����ݽ������˳���֪�����ֽ����Ļ��˳��Ϊ��þ������ͭ������������������������ͭ�Ļ����Һ�У�����һ���������ۣ�����������������Ӧ��������������������������ͭ��Ӧ��������������ͭ��������������þ��Ӧ���������еμ�ϡ���ᣬ�����ݲ�����˵��������һ��������������Ҳһ����������ͭ������������һ����Ag��Cu��Fe����Һ��һ���еĽ���������Mg2+��Fe2+��
��5����μӷ�Ӧ�������������x��
Fe+H2SO4=FeSO4+H2��
56 98
11.2g x
$\frac{56}{11.2g}$=$\frac{98}{x}$
x=19.6g
ϡ���������ʵ���������Ϊ��$\frac{19.6g}{120g}$��100%=16.3%��
��ϡ���������ʵ���������Ϊ16.3%��
�ʴ�Ϊ����1����55.85����B��
��3��������ˮ��
��4��Ag��Cu��Fe��Mg2+��Fe2+��
��5��16.3%��
���� �ڽ������ʱ�����ȷ������п�������⣬Ȼ����ѧ����֪ʶ�����е���ʾ���н��


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��� | B�� | ţ�� | C�� | ���� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NH4��2SO4���ڸ��Ϸ��� | |
| B�� | ũ�����������Ӫ��Ԫ��ֻ�е����ͼ����� | |
| C�� | �ʿ���ǿ����Ŀ������������� | |
| D�� | �̬��������ʯ�һ��ʩ�ÿ���������߷�Ч |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȼ�պϳ���ά�����ŵ��ս���ë����ζ | |
| B�� | ������������ȼ�ղ����������� | |
| C�� | ������粒�������ˮ����Һ�¶����� | |
| D�� | ��˿�������о���ȼ�գ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2O3 | B�� | FeO | C�� | Fe3O4 | D�� | Fe6O8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
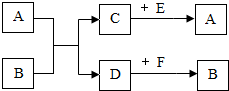 A��B��C��D��E��F���dz��л�ѧ�г��������ʣ�A��C���Ԫ����ͬ��DWie��ɫ���嵥�ʣ�����֮����ת�����£���ͼ�С�������ʾ���ʼ���ڵ�ת����ϵ����Ӧ��������ȥ��
A��B��C��D��E��F���dz��л�ѧ�г��������ʣ�A��C���Ԫ����ͬ��DWie��ɫ���嵥�ʣ�����֮����ת�����£���ͼ�С�������ʾ���ʼ���ڵ�ת����ϵ����Ӧ��������ȥ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl��Na2CO3��-����ϡ���� | |
| B�� | Fe��Cu��-����ϡ���� | |
| C�� | CaCl2��CaCO3��-��ˮ�ܽ⣬���ˣ��������ᾧ | |
| D�� | CO2��CO��-ͨ����������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com