
分析 碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,由于150克碳酸钙完全反应,可利用碳酸钙的质量根据反应的化学方程式,计算生成气体二氧化碳的质量,消耗10%的盐酸的质量;
利用V=$\frac{m}{ρ}$,根据二氧化碳质量计算出标准状况下气体的体积.
解答 解:设生成二氧化碳的质量为x,消耗10%的盐酸的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
150g y×10% x
$\frac{100}{150g}=\frac{73}{y×10%}=\frac{44}{x}$
x=66g,y=1095g
标准状况下体积V=$\frac{66g}{1.96g/L}$≈33.67升
答:二氧化碳体积为33.67L,盐酸质量为1095克.
点评 本题为根据反应的化学方程式计算的基础计算,需要注意正确的书写格式及完整的步骤,特别是还需要使用质量与体积的关系式计算出气体的体积.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
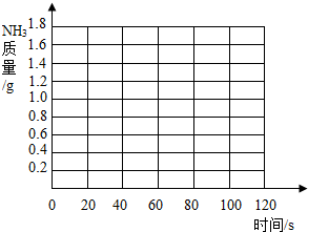
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含有碳、氢元素基础 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 硫酸镁溶液可以和氢氧化钠溶液反应
硫酸镁溶液可以和氢氧化钠溶液反应 SO42-
SO42-  Mg2+
Mg2+  Na+
Na+查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com