
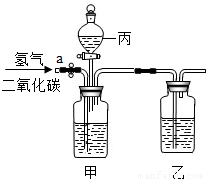
 有稀盐酸、浓硫酸和氢氧化钠溶液.要用如图所示装置对H2和CO2的混合气体进行分离和干燥,则:
有稀盐酸、浓硫酸和氢氧化钠溶液.要用如图所示装置对H2和CO2的混合气体进行分离和干燥,则:

科目:初中化学 来源: 题型:阅读理解

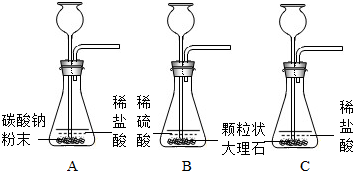
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气体 | 反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
| B | 产生气泡,速度迅速减慢,几秒钟后反应几乎停止 | 无法持续产生气体,不能用于实验室制取CO2 |
| C | 产生气泡,反应速率均匀、适中,持续放出气体 产生气泡,反应速率均匀、适中,持续放出气体 |
产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
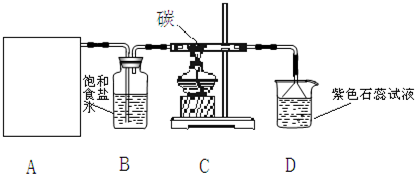
| ||
| ||
| ||
| 实验序号 | 实验操作 | 预期现象和结论 |
| ① | 将稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热 将稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热 |
若有黄绿色气体生成,则与氯离子浓度有关, 若没有黄绿色气体生成,则与氯离子浓度无关. 若有黄绿色气体生成,则与氯离子浓度有关, 若没有黄绿色气体生成,则与氯离子浓度无关. |
| ② | 将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热 将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热 |
若有黄绿色气体生成,则与氢离子浓度有关, 若没有黄绿色气体生成,则与氢离子浓度无关. 若有黄绿色气体生成,则与氢离子浓度有关, 若没有黄绿色气体生成,则与氢离子浓度无关. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com