
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| 烧杯内物质总质量/g | 217.6 | 215.8 | 214.4 | 213.4 | 213.4 |
分析 首先根据质量守恒定律求出生成的二氧化碳的质量即反应前后物质总质量的差值,然后把二氧化碳的质量代入化学方程式计算就可求出参加反应的碳酸钙的质量,碳酸钙的质量与大理石的质量的百分比即为大理石样品中碳酸钙的质量分数.
解答 解:(1)根据质量守恒定律可得,生成的二氧化碳的质量是200g+20g-213.4g=6.6g;
故答案为:6.6;
(2)设20g大理石样品中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g
$\frac{100}{x}=\frac{44}{6.6g}$
x=15g
大理石样品中碳酸钙的质量分数为:$\frac{15g}{20g}$×100%=75%
答:大理石样品中碳酸钙的质量分数为75%.
点评 本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式进行有关的计算,培养学生分析问题的能力和解决问题的能力.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe和Cu | B. | Ag和Fe | C. | Ag和Cu | D. | Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 锌粉无剩余,溶液中若有Cu2+,则必定有Fe2+ | |
| B. | 锌粉有剩余,溶液中只有Fe2+,而无Zn2+和Cu2+ | |
| C. | 锌粉无剩余,溶液中无Cu2+,一定有Zn2+,可能有Fe2+ | |
| D. | 锌粉有剩余,溶液中只有Zn2+,而无Cu2+和Fe2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
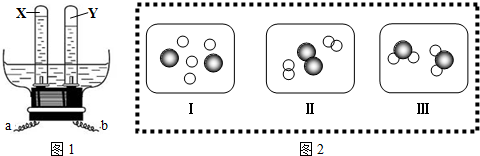
| A. | 图1中,a电极是直流电源的负极 | |
| B. | 图1中X与Y的分子个数比为1:2,质量比为8:1 | |
| C. | 图2微观图示Ⅰ中,元素的化合价分别为+1和-2 | |
| D. | 若图2表示合成水的微观示意图,则反应过程顺序为Ⅱ→Ⅰ→Ⅲ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com