
分析 由菱锌矿石的质量、ZnCO3含量,根据制备锌的化学方程式可以列式计算出理论上最多可制得锌的质量.
解答 解:100吨这样的菱锌矿含ZnCO3的质量为100t×62.3%=62.3t.
设理论上最多可制得锌的质量为x.
由ZnCO3$\frac{\underline{\;高温\;}}{\;}$ZnO+CO2↑,ZnO+CO$\frac{\underline{\;高温\;}}{\;}$Zn+CO2,可得:
ZnCO3 ~Zn
125 65
62.3t x
$\frac{125}{65}$=$\frac{62.3t}{x}$ x≈32.4t
答:理论上最多可制得锌的质量为32.4t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:选择题
| A. | 电解水实验中,与电源正、负极相连的电极上产生的气体体积比为2:1 | |
| B. | 把铁丝放入硫酸铜溶液一段时间后取出,铁丝表面覆盖一层红色物质 | |
| C. | 加热碳酸氢铵时,产生有刺激性气味的气体,同时管壁出现小水珠 | |
| D. | 把铝粉洒到酒精灯火焰上,铝粉燃烧并发出耀眼的白光 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由不同种元素组成的物质一定是混合物 | |
| B. | 某物质能与碱反应生成盐和水,则该物质一定是酸 | |
| C. | 向某固体中加入稀盐酸有气体产生,则该固体一定是较活泼金属 | |
| D. | 饱和溶液析出晶体后,溶质质量分数不一定减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
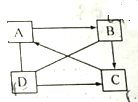 有A、B、C、D四种物质,其中B是建筑材料的主要成分:C是引起温室效应的主要气体;D与A、B均发生复分解反应.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应),请回答下列问题:
有A、B、C、D四种物质,其中B是建筑材料的主要成分:C是引起温室效应的主要气体;D与A、B均发生复分解反应.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应),请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫化丙烯分子由3个碳元素、6个氢元素和1个硫元素构成 | |
| B. | 硫化丙烯中硫元素的质量分数最大 | |
| C. | 硫化丙烯分子中碳、氢、硫元素质量比为3:6:1 | |
| D. | 74g硫化丙烯中硫元素的质量为32g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验 | 实验过程 | 实验结果 |
| 1 | A中加入足量石灰石,并充满二氧化碳;B中盛满饱和碳酸氢钠溶液.将10mL稀盐酸注入瓶中. | 量筒内液体体积,实验2比实验1少约1%. |
| 2 | A中加入足量石灰石,并充满二氧化碳;B中盛满蒸馏水.将10mL稀盐酸(浓度与实验1相同)注入瓶中. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com