
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
分析 (1)HClO是一种酸性比盐酸弱的酸,在常温下分解,反应为2HClO=2HCl+O2↑,分析溶液pH的变化;
(2)根据漂白粉与稀盐酸反应生成次氯酸和氯化钙写出反应的方程式;
(3)【猜想】
根据题目信息可知,漂白粉的主要成分是Ca(ClO)2、CaCl2,Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,其部分变质,所以一定有生成的碳酸钙,还有未反应的CaCl2,和部分未反应的Ca(ClO)2;
【实验探究】要证明碳酸钙的存在,可以加入稀盐酸,并将生成气体通入澄清的石灰水;要检验是否含有Ca(ClO)2,可根据HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色设计实验;
【交流与反思】根据信息确定保存方法.
解答 解:(1)HClO是一种酸性比盐酸弱的酸,在常温下分解,反应为2HClO=2HCl+O2↑,故溶液的酸性增强,pH减小;
故答案为:减小;
(2)根据复分解反应的原理,漂白粉与稀盐酸反应生成次氯酸和氯化钙,反应为Ca(ClO)2 +2HCl=2HClO+CaCl2;
故答案为:Ca(ClO)2 +2HCl=2HClO+CaCl2;
(3)【猜 想】根据题目信息可知,漂白粉的主要成分是Ca(ClO)2、CaCl2,Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,其部分变质,所以一定有生成的碳酸钙,还有未反应的CaCl2,和部分未反应的Ca(ClO)2;
故答案为:CaCl2、Ca(ClO)2、CaCO3;
【实验探究】要证明猜想2成立,就是设计实验检验碳酸钙和次氯酸钙的存在;根据实验现象:有气体产生,气体使石灰水变浑浊;说明是在样品中加入稀盐酸,碳酸钙与盐酸反应生成二氧化碳使澄清的石灰水变浑浊;在上述反应后的试管中加少量品红溶液,根据(3)分析,盐酸与Ca(ClO)2 反应生成HClO,而HClO具有漂白性,能使品红等有色物质褪色;
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
点评 本题考查了根据题目信息分析解答问题的能力,有关实验方案的设计,是中考的热点之一,要依据信息结合已有的知识仔细分析解答.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:选择题
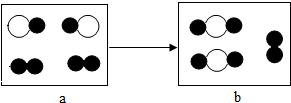 如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,a、b分别表示反应前和反应后的物质,下列说法不正确的是( )
如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,a、b分别表示反应前和反应后的物质,下列说法不正确的是( )| A. | a、b均属于混合物 | B. | 该反应属于置换反应 | ||
| C. | 该反应的生成物可能是氧化物 | D. | 该反应属于化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的大小发生了变化 | B. | 分子的运动速度发生变化 | ||
| C. | 分子之间的间隔发生了变化 | D. | 分子的质量发生了变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 开发新能源,禁止开采和使用化石燃料 | |
| B. | 在生产和生活中提倡使用节能技术和节能用具 | |
| C. | 提倡乘坐公交车,骑自行车或步行的出行方式 | |
| D. | 植树造林,严禁乱砍滥伐 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气加氧气等于水 | |
| B. | 氢气和氧气在点燃条件下反应生成水 | |
| C. | 两个氢分子加一个氧分子等于2个水分子 | |
| D. | 2g氢气和1g氧气反应生成2g水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
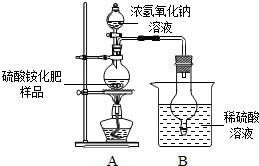 (1)硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图所示的装置进行实验.已知△
(1)硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图所示的装置进行实验.已知△查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com