解:(1)稀硫酸与氢氧化钠固体反应,生成的气体是二氧化碳,用集气瓶收集.
故答案为:集气瓶.
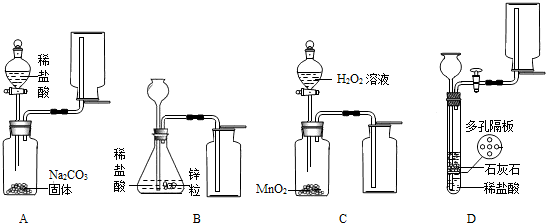
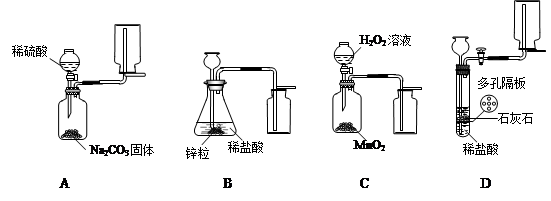
(2)A中生成的气体是二氧化碳,不可用向下排空气法收集,所以图中收集方法不正确;B中锌粒与稀盐酸反应,生成的气体是氢气,应该用向下排空气法收集,所以收集的方法不正确;C中的双氧水和二氧化锰反应生成的气体是氧气,应该用向下排空气法收集,收集方法正确,反应方程式是:2H
2O
2
2H
2O+O
2↑;D中稀盐酸和石灰石反应,生成二氧化碳,应用向上排空气法收集,收集方法不正确.
故答案为:C;2H
2O
2
2H
2O+O
2↑.
(3)实验时需要溶质质量分数为9.8%的稀硫酸138g,其中硫酸的量是:138×9.8%=13.5g.
所以需要溶质质量分数为98%的浓硫酸:13.5÷98%=13.8g
根据公式:m=ρ?v 可知需要取溶质质量分数为98%,密度为1.84g/mL的浓硫酸:v=
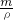
=
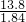
=7.5mL.所以要选用10mL的量筒.
故答案为:10;7.5.
分析:(1)稀硫酸与氢氧化钠固体反应,生成的气体是二氧化碳,用集气瓶收集.
(2)A中生成的气体是二氧化碳,不可用向下排空气法收集;B中锌粒与稀盐酸反应,生成的气体是氢气,应该用向下排空气法收集;C中的双氧水和二氧化锰反应生成的气体是氧气,应该用向下排空气法收集;D中稀盐酸和石灰石反应,生成二氧化碳,应用向上排空气法收集.
(3)根据提供的数据,先计算出实验时需要溶质质量分数为9.8%的稀硫酸138g,中含有的硫酸的质量,再根据浓硫酸的密度计算出所需浓硫酸的体积,然后确定所用量筒.
点评:此题体现了学科直接的相互渗透,所以同学们要注意学科直接的均衡发展.

 2H2O+O2↑;D中稀盐酸和石灰石反应,生成二氧化碳,应用向上排空气法收集,收集方法不正确.
2H2O+O2↑;D中稀盐酸和石灰石反应,生成二氧化碳,应用向上排空气法收集,收集方法不正确. 2H2O+O2↑.
2H2O+O2↑.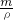 =
=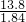 =7.5mL.所以要选用10mL的量筒.
=7.5mL.所以要选用10mL的量筒.


 ⊥
⊥
 ⊥
⊥