
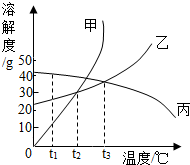
 如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题:
如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题:分析 (1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)据物质溶解度随温度变化可判断提纯物质的方法;
(3)据该温度下物质的溶解度分析解答;
(4)明确饱和溶液中溶质的质量质量分数的计算式,物质的溶解度随温度变化情况,进而分析温度变化溶质的质量分数变化情况.
解答 解:(1)据溶解度曲线可知,t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是:丙>乙>甲,故答案为:丙>乙>甲;
(2)甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小,所以甲中含有少量的乙可采用冷却热饱和溶液或降温结晶的方法提纯甲,故答案为:冷却热饱和溶液(或降温结晶);
(3)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量=30g:100g=3:10;故答案为:3:10;
(4)t3℃时,将乙和丙两物质的饱和溶液降温到t1℃,所得溶液中的浓度大小关系为:乙<丙,因为乙有固体析出,丙的质量分数不变,故答案为:<;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 为节约药品,将实验剩余药品放回原试剂瓶 | |
| B. | 实验完毕后先用嘴吹灭酒精灯,再盖上灯帽 | |
| C. | 用托盘天平称量没有腐蚀性的药品时,可用手直接拿取砝码 | |
| D. | 向试管里滴入液体时,胶头滴管竖直悬空在试管口上方 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com