
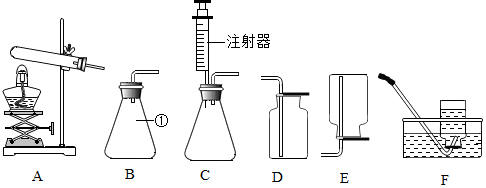
分析 (1)根据常见的化学仪器的名称,进行分析解答.
(2)实验室用A装置制取氧气,属于固体加热型,试管口没有放一团棉花,采用的加热氯酸钾和二氧化锰混合物的方法,据此进行分析解答.
(3)根据氧气的验满方法,进行分析解答.
(4)要得到平稳的氧气流,采用的是分解过氧化氢溶液的方法,应选用便于控制过氧化氢滴加速率的装置,进行分析解答.
解答 解:(1)仪器①的名称是锥形瓶.
(2)用A装置制取氧气,属于固体加热型,试管口没有放一团棉花,采用的加热氯酸钾和二氧化锰混合物的方法,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用D装置收集氧气,验证氧气是否收集满的方法是将带火星的木条放在集气瓶口,若木条复燃,说明已集满.
(4)要得到平稳的氧气流,采用的是分解过氧化氢溶液的方法,应选用便于控制过氧化氢滴加速率的装置,选用的发生装置是C,注射器可控制过氧化氢的滴加的快慢,便于控制反应速率,得到平稳的氧气流.用排水法收集的气体比较纯净,应选择的发生装置和收集装置是CF.
故答案为:(1)锥形瓶;(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(3)将带火星的木条放在集气瓶口,若木条复燃,说明已集满;(4)CF.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后,往试管中滴加过氧化氢溶液,观察现象. | 溶液仍然为红色 | 不是过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量的水. | 溶液变成红色 | 氢氧化钠溶液浓度过大,导致溶液颜色褪去 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加水溶解后再加入少量CaCl2溶液 | 产生白色沉淀 | 假设Ⅱ不成立,反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品 | 有气体产生,澄清的石灰水变浑浊 | 假设Ⅰ不成立.则样品的成分是Na2CO3和NaHCO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 10 | 30 | 50 | 70 | 90 |
| 溶解度/g | 27.7 | 39.3 | 49.0 | 54.1 | 51.1 |
| A. | 硫酸镁的溶解度随温度升高而增大 | |
| B. | 10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液 | |
| C. | 50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100 | |
| D. | 70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 尿液4.7~8.4 | B. | 唾液6.6~7.1 | C. | 血浆7.35~7.45 | D. | 胃液0.9~1.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com