
| 实验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铁锈消失的时间/s |
| ① | 6 | 20 | 240 |
| ② | 10 | 20 | 115 |
| 实验编号 | 硫酸的质量分数/% | 反应温度/℃ | 铁锈消失的时间/s |
| ③ | 6 | 20 | 310 |
| ④ | 10 | 20 | 155 |
分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)根据表格信息来分析;
(3)根据盐酸中存在的离子来分析;可根据加入含有氯离子的化合物的溶液观察反应速率快慢来分析;
(4)反应速率的快慢还可能与铁锈和酸的接触面积有关.
解答 解:(1)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.故填:Fe2O3+6HCl═2FeCl3+3H2O;
(2)由表格信息可知,酸的种类不同,导致了反应快慢有着区别;故填:酸的种类;
(3)盐酸中存在氢离子和氯离子,其中加快反应速率的离子是氢离子,故填:H+;
在铁锈与硫酸反应的试管中加入少量氯化钠溶液,发现反应速率没有改变,说明不是其中的氯离子所起的作用,故填:在铁锈与硫酸反应的试管中加入少量氯化钠溶液,观察反应速率的快慢;
(4)铁锈与酸的接触面积也可能会影响反应的速率,故填:将长短相同、粗细不同的两根生锈的铁丝放入等体积、等溶质质量分数的稀盐酸中,观察现象.发现细铁丝表面的铁锈很快就被除去,而粗铁丝表面的铁锈较慢,故可推断出铁锈和酸反应的快慢还与铁锈与酸的接触面积有关.
点评 本题是通过控制不同的量来探究能够影响反应速度的因素的,这类似于物理上所学的控制变量法来解决问题,我们在解答时要注意仔细分析比较,从而得出正确的解答


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 硝酸钾与氯化钾的溶解度曲线如右图所示,回答下列问题:
硝酸钾与氯化钾的溶解度曲线如右图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 课本上说螺壳中含有碳酸钙,小明认为可以利用如图甲所示装置进行检验.往容器中放入螺壳并注入稀盐酸,如果观察到有气泡产生、涂在玻璃片下表面的澄清石灰水变浑浊,就可以证明螺壳中含有碳酸钙.请评价小明的检验方法是否正确,并说明理由:滴加稀盐酸,若有气体生成,能使澄清石灰水变浑浊,则该物质中含有碳酸根离子.小明收集螺壳与稀盐酸反应产生的二氧化碳,并用如图乙所示装置验证二氧化碳与氢氧化钠能够发生反应.在广口瓶中先加入适量氢氧化钠溶液,再加入适量稀盐酸,预期观察到的现象是气球先膨胀,后变瘪.
课本上说螺壳中含有碳酸钙,小明认为可以利用如图甲所示装置进行检验.往容器中放入螺壳并注入稀盐酸,如果观察到有气泡产生、涂在玻璃片下表面的澄清石灰水变浑浊,就可以证明螺壳中含有碳酸钙.请评价小明的检验方法是否正确,并说明理由:滴加稀盐酸,若有气体生成,能使澄清石灰水变浑浊,则该物质中含有碳酸根离子.小明收集螺壳与稀盐酸反应产生的二氧化碳,并用如图乙所示装置验证二氧化碳与氢氧化钠能够发生反应.在广口瓶中先加入适量氢氧化钠溶液,再加入适量稀盐酸,预期观察到的现象是气球先膨胀,后变瘪.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
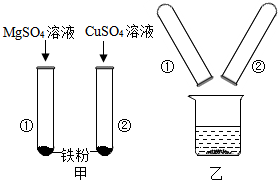 某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)
某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com