
·ÖĪö £Ø1£©øßĪĀĢõ¼žĻĀ£¬Įņ»ÆŃĒĶŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĶŗĶ¶žŃõ»ÆĮņ£»
£Ø2£©Ėį½žŹ±£¬Ńõ»ÆĶŗĶĻ”ŃĪĖį·“Ӧɜ³ÉĀČ»ÆĶŗĶĖ®£¬Ńõ»ÆĢśŗĶĻ”ŃĪĖį·“Ӧɜ³ÉĀČ»ÆĢśŗĶĖ®£»
·“Ó¦Īļ½Ó“„Ć껿Ō½“󣬷“Ó¦ĪļÅضČŌ½“ó£¬ĪĀ¶ČŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½æģ£»
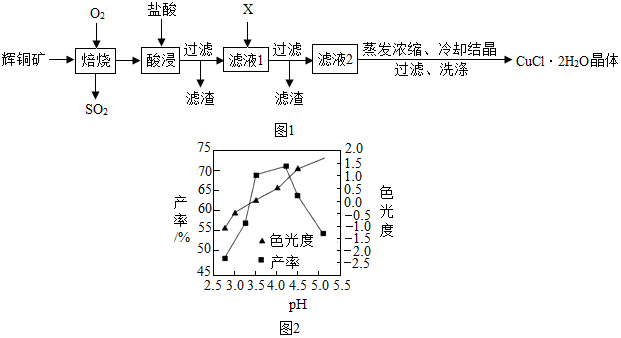
£Ø3£©øł¾ŻĶ¼ÖŠĢį¹©µÄŠÅĻ¢æÉŅŌÅŠ¶ĻpHµÄ½ĻŗĻĄķ·¶Ī§£»
ŹµŃéŹŅÓĆpHŹŌÖ½æÉŅŌ²ā¶ØČÜŅŗµÄpH£®
½ā“š ½ā£ŗ£Ø1£©±ŗÉÕÖŠÉś³ÉŗŚÉ«¹ĢĢ壬ŹĒŅņĪŖøßĪĀĢõ¼žĻĀ£¬Įņ»ÆŃĒĶŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĶŗĶ¶žŃõ»ÆĮņ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu2S+2O2$\frac{\underline{\;øßĪĀ\;}}{\;}$2CuO+SO2£®
¹ŹĢī£ŗCu2S+2O2$\frac{\underline{\;øßĪĀ\;}}{\;}$2CuO+SO2£®
£Ø2£©Ėį½žŹ±£¬Ńõ»ÆĶŗĶĻ”ŃĪĖį·“Ӧɜ³ÉĀČ»ÆĶŗĶĖ®£¬Ńõ»ÆĢśŗĶĻ”ŃĪĖį·“Ӧɜ³ÉĀČ»ÆĢśŗĶĖ®£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCuO+2HClØTCuCl2+H2O£¬Fe2O3+6HClØT2FeCl3+3H2O£»
A£®ŃÓ³¤Ėį½žŹ±¼ä²»ÄܼÓæģ·“Ó¦ĖŁĀŹ£»
B£®½«»ŌĶæó·ŪĖ飬Ōö“óĮĖ·“Ó¦Īļ½Ó“„Ć껿£¬Äܹ»¼Óæģ·“Ó¦ĖŁĀŹ£»
C£®ŹŹµ±Ōö¼ÓŃĪĖįÅØ¶Č£¬æÉŅŌ¼Óæģ·“Ó¦ĖŁĀŹ£®
¹ŹĢī£ŗCuO+2HClØTCuCl2+H2O£»A£®
£Ø3£©ČēĶ¼2ĖłŹ¾£¬pHĪŖ3.5-4.0Ź±£¬²śĀŹ½Ļøߣ¬²¢ĒŅCuCl2•2H2O¾§ĢåµÄÉ«¹ā¶Č·¶Ī§ŌŚ-0.5”«0.5Ö®¼ä£¬ŹōÓŚŗĻøń²śĘ·£¬Ņņ“Ė×ŪŗĻæ¼ĀĒÖʱøŹ±Ó¦æŲÖĘpHµÄ½ĻŗĻĄķ·¶Ī§ŹĒ3.5-4.0£»
ŹµŃéŹŅÓĆ pH ŹŌÖ½²ā¶ØČÜŅŗ pH µÄ²Ł×÷·½·ØŹĒ£ŗŌŚ°×“É°å»ņ²£Į§Ę¬ÉĻ·ÅŅ»Š”ʬpH ŹŌÖ½£¬ÓĆ²£Į§°ōÕŗČ”ČÜŅŗµĪµ½pHŹŌÖ½ÉĻ£¬°ŃŹŌÖ½ĻŌŹ¾µÄŃÕÉ«Óė±ź×¼±ČÉ«æØ±Č½Ļ£®
¹ŹĢī£ŗ3.5-4.0£»ŌŚ°×“É°å»ņ²£Į§Ę¬ÉĻ·ÅŅ»Š”ʬpH ŹŌÖ½£¬ÓĆ²£Į§°ōÕŗČ”ČÜŅŗµĪµ½pHŹŌÖ½ÉĻ£¬°ŃŹŌÖ½ĻŌŹ¾µÄŃÕÉ«Óė±ź×¼±ČÉ«æØ±Č½Ļ£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éĪļÖŹµÄŠŌÖŹ£¬½ā“šŹ±ŅŖøł¾Żø÷ÖÖĪļÖŹµÄŠŌÖŹ£¬½įŗĻø÷·½ĆęĢõ¼ž½ųŠŠ·ÖĪö”¢ÅŠ¶Ļ£¬“Ó¶ųµĆ³öÕżČ·µÄ½įĀŪ£®


 æŖŠÄŹŌ¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø
æŖŠÄŹŌ¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø Ė«»łĶ¬²½µ¼ŗ½ŃµĮ·ĻµĮŠ“š°ø
Ė«»łĶ¬²½µ¼ŗ½ŃµĮ·ĻµĮŠ“š°ø »ĘøŌŠ”דŌŖĶ¬²½¼ĘĖćĢģĢģĮ·ĻµĮŠ“š°ø
»ĘøŌŠ”דŌŖĶ¬²½¼ĘĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  Ģ½¾æÖŹĮæŹŲŗć¶ØĀÉ | B£® |  Ģ½¾æČ¼ÉÕµÄČżøöĢõ¼ž | ||
| C£® |  ²ā¶ØæÕĘųÖŠŃõĘųµÄŗ¬Įæ | D£® |  Ģ½¾æĢśÉśŠāµÄĢõ¼ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3.5gĒāŃõ»ÆÄĘČÜŅŗ | B£® | 2.8gŃõ»ÆĢś | ||
| C£® | 2.8gĢ¼ĖįÄĘČÜŅŗ | D£® | 2.4gĆ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻõĖį¼ŲæÉÓĆ×÷»Æ·Ź | B£® | ĀČ»ÆÄĘæÉŅŌɱ¾ś | ||
| C£® | ĀČ»ÆÄʵÄŃęÉ«·“Ó¦³Ź×ĻÉ« | D£® | Čܽā¶ČµÄ±ä»ÆŹÜĪĀ¶ČµÄÓ°Ļģ¶¼ŗÜ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com