
| A. | 如果合金为锌和铁,m不可能是0.2g | |
| B. | 反应后溶液中的溶质一定只有两种 | |
| C. | 如果合金为锌和镁,m可能是0.1g,则该合金中锌的质量分数为50% | |
| D. | 如果合金为锌和铁,所加稀盐酸的溶质的质量分数一定等于7.3% |
分析 假设这6.5 g全部为锌,依据方程式计算出生成氢气为0.2g,所以剩余的金属中假设都是6.5g时产生氢气的质量必须有比0.2g大的,有比0.2g小的,然后结合金属与酸反应时生成氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,再进行进一步分析即可.
解答 解:A、假设6.5g全部为锌,设生成氢气质量为x则:
Zn+2HCl═ZnCl2+H2↑
65 2
6.5g x
$\frac{65}{6.5g}=\frac{2}{x}$
解得:x=0.2g
同理可计算出6.5g铁与足量盐酸反应产生氢气的质量大于0.2g,
所以可以判断锌中含有铁,最终生成的氢气的质量都必然大于0.2g,故A正确;
B、如果盐酸过量的话,反应后的溶液中除了两种金属生成的盐溶质还有氯化氢,所以反应后溶液中的溶质可能有三种,故B错误;
C、由A可知6.5g全部是锌时,生成氢气的质量为0.2g,同理可计算出若6.5g全部是镁,与足量盐酸反应产生氢气的质量大于0.2g,
所以可以判断如果锌中含有镁,最终生成的氢气的质量必然大于0.2g,如果合金为锌和镁,m不可能是0.1g,故C错误;
D、从上述方程式中可以分析得出,6.5g锌消耗盐酸的质量为7.3g,即此时盐酸的浓度为7.3%,等质量的铁消耗盐酸的质量更多,所以若混合物为锌和铁,则稀盐酸中溶质质量分数一定大于7.3%,故D不正确.
故选:A.
点评 相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量和化合价有关,同价态的金属若相对原子质量越大,产生的氢气质量越小.


 名师点拨卷系列答案
名师点拨卷系列答案科目:初中化学 来源: 题型:解答题
 为测定锌铜合金中锌的含量,取该合金放入盛有稀硫酸的锥形瓶中(如图),发生反应.多次实验后,取平均值所得数据如下表:
为测定锌铜合金中锌的含量,取该合金放入盛有稀硫酸的锥形瓶中(如图),发生反应.多次实验后,取平均值所得数据如下表:| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制取气体时应先检查装置的气密性,然后再装入药品 | |
| B. | 制取氧气停止加热时,应先把导气管移出水面,然后再熄灭酒精灯 | |
| C. | 一氧化碳还原氧化铜开始时,应先用酒精灯加热,然后再向盛氧化铜的玻璃管中通入一氧化碳 | |
| D. | 一氧化碳还原氧化铜结束时,应先停止加热,然后再继续向盛氧化铜的玻璃管中通入一氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
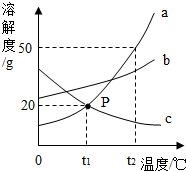 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com