有10g木炭粉,在空气中燃烧生成23.2g气体,将这些气体通入足量的澄清石灰水,滤出沉淀,干燥,称重得40g.求共消耗掉多少克的炭?
【答案】
分析:碳燃烧的产物有二氧化碳和一氧化碳两种,根据碳酸钙沉淀的质量求出燃烧生成的二氧化碳的质量,再求得一氧化碳的质量,然后根据二氧化碳和一氧化碳中碳元素的质量分数,分别求出碳元素的质量,两者之和就是碳元素的质量.
解答:解:设燃烧生成的二氧化碳的质量为X
CO
2+Ca(OH)
2=H
2O+CaCO
3↓
44 100
X 40g
44:100=X:40g
解得,X=17.6g
一氧化碳的质量为23.2g-17.6g=5.6g.
所以消耗掉碳的质量为:17.6g×

×100%+5.6g×
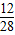
×100%=7.2g.
答:共消耗掉7.2克的碳.
点评:根据化学方程式表示反应中各物质的质量关系,利用已知物质质量,可对反应中其它物质质量进行计算.

 ×100%+5.6g×
×100%+5.6g×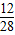 ×100%=7.2g.
×100%=7.2g.

 阅读快车系列答案
阅读快车系列答案